- 照射法の進歩
- 分割照射法
- 原著論文
- 1904,1906 Bergonié-Tribondeauの法則
- 1922,1927 低線量率長時間照射法の優位性
- 1932 遷延分割照射法
- 関連事項
- 放射線感受性の修飾
- 放射線生物学の発展
- 原著論文
- 1956 細胞生存曲線
- 1959 Elkind回復
- 新しい照射装置
- ・超高圧X線
- ・ベータトロン
- ・直線加速器(ライナック)
- ・遠隔コバルト照射装置
- 原著論文
- 1955 直線加速器の導入
- 1952 遠隔コバルト照射装置の初報
- 関連事項
- 電子線照射と術中照射
照射法の進歩
分割照射法
放射線治療効果が,概ね総線量に比例することは初期から先験的に理解されていたが,どこで照射を止めるかについては確たる基準はなく,皮膚の状態を見ながら照射するのが一般的であった.また初期のX線装置は低出力であったため,自ずから毎日照射する分割照射となったが,これを時間的にどのように配分するかについての理論はなく,1日1時間~数時間,術者の都合に応じて照射されていた.
現在の知識でいえば,線量分割の基礎は細胞の感受性と回復力にあるが,細胞感受性を初めて論じたのは1906年,Bergonié & Tribondeauで,未熟な細胞,分裂している細胞の感受性が高いことを動物実験の結果から導いた[→原著論文].いわゆる Bergonié-Tribondeauの法則で,現在も放射線生物学の基本である.これをもとに,その後様々な分割照射法が検討された.
1910年代には強力なCoolidge管が使用できるようになり,大線量を短時間に照射することも可能となった.当時,少量の線量では逆に腫瘍細胞の増殖を刺激する「刺激線量」の存在が考えられており,このため短時間に大量線量を1回照射し一気に治療する方法が提案された.この massive single dose technique は,ドイツのエルランゲン大学婦人科 のLudwig Seitz & Hermann Wintzが子宮癌の治療に適用したもので,通称 Erlangen法と言われるが[1],副作用が強く失敗に終わり,この経験から分割照射法の研究が進められた.
分割照射法を初めて実際に検討したのはフランスのキュリー研究所のClaude Regaudで,1922年,ヒツジの精巣にラジウム針を刺入する去勢実験で,低線量率長時間照射の方が高線量率短時間照射よりも有効であることを示し[→原著論文],1927年にはX線でも同様の結果を得た.そして,同じく分裂頻度の高い癌細胞についても同様の理論が当てはまるとして,これに則った治療が計画された.
Regaudの動物実験の結果をもとに,照射期間10日が最適であるとされたが,ラジウム研究所ではこの結果をもとに,低線量率(2R/分),1回1時間,1日2回,25~35時間,20日以内というプロトコルを原則とした.しかし実際には諸般の事情で治療期間が一定せず,40日まで延長することがあった.1932年にHenri Coutardが頭頸部癌の治療成績を分析したところ,治療期間が遷延しても腫瘍に対する治療効果は変化せず,むしろ粘膜,皮膚の副作用が軽減されて全体に成績が向上することがわかった[→原著論文].以来,この方法は遷延分割照射法(protrahiert-fraktionierte Bestrahlung)とよばれてその後の放射線治療の指針となり,1日2Gy×30回,計60Gyとするいわゆるconventional techniqueは,現在も基本的な照射法である.
原著論文
【要旨・解説】放射線治療の基本原理である,いわゆるBergonié-Tribondeauの法則を提案した論文.Jean A. Bergonié (1857-1925),Louis F. A. Tribondeau (1872-1918)はそれぞれフランスの物理学者,臨床医.雄の動物にX線を照射すると不妊になることはこれ以前から知られていたが,その背景を病理組織学的に確認することがそもそもの目的であった.4編にわけて報告された1904~5年の論文では,ラットの一側の精巣にX線を照射,対側を対照として,精子が存在する精細管と存在しない精細管の比をもって定量的評価とすると同時に,その組織像を評価している.その結果,精母細胞,精祖細胞,精子細胞など精細胞系の細胞は,線量にかかわらず様々な変化があり破壊されているが,間質細胞であるSertoli細胞は保たれていることが判明した.
1906年の論文は,この精上皮細胞とSertoli細胞の組織像の差を理論的に説明しようとしたもので「X線は増殖能力が大きい細胞,核分裂期の細胞,分化度の低い細胞により強く作用する」 という仮説を提案している.さらにこれによって,腫瘍と正常細胞のX線感受性,正常細胞間のX線感受性が説明できる,従って腫瘍と正常組織の増殖能の差がなければ放射線治療はできないと述べている.わずか2頁足らずであるが,その後現在に至るまで放射線治療の理論的背景を提供することになる記念碑的な論文である.
【要旨・解説】フランスのパスツール研究所のRegaudによる,低線量率照射の有効性を実証した初の論文.当時,いわゆるErlangen法に代表されるように,癌の放射線治療は大線量を短期間で照射することが一般的であった.一方で,一回照射に比較して分割照射が効果的であるという考え方もあった.
1922年の最初の論文は,ヒツジの精巣にラジウム針を刺入して精子の消失状態によってその効果を評価したもので,大線量を短時間照射するよりも,低線量を長時間照射する方が効果的であることを示した.具体的には15mcd,5時間半では去勢効果は不完全であったが,4.6mcd,28時間では完全な去勢効果が得られた.
1927年の論文は,ウサギの精巣をX線照射する実験で,特に分割照射によって皮膚に障害を来たすこと無く精巣に有効な線量を照射できることを示している.具体的には4,500~5,000Rを2~6分割照射して皮膚や直腸粘膜に障害を及ぼすことなく有効な去勢効果がえられたのに対し,1回大量照射では皮膚障害を来たさずに去勢効果は得られなかったとしている.
この理論はその後,子宮頸癌治療のパリ法の基礎ともなった.
【要旨・解説】パリのラジウム研究所における頭頸部癌のX線単独治療の方法とその成績の報告.かなり散漫な論文で,意図するところがわかりにくいが,重要なことは同施設のRegaudの理論に従って,小線量を長期間にわたって照射する,いわゆる遷延分割照射法による治療を行なった点である.具体的には,6,500~8,000rを15~40日で照射しており,これ以上の大線量にしても良い効果が得られないとしている.また照射期間を延長すると,治癒率が低下するが,再発率も低下するという.
照射5年後の治癒率が,扁桃癌,下咽頭癌,喉頭癌でそれぞれ23%,10%,28%という数字は,ほぼ全例が進行癌であった当時としては必ずしも悪い成績ではないと言えよう.しかし基本的に対向2門で大線量を照射するため,高度の皮膚炎,粘膜炎が必発で,掲載されている写真は現在からみるとやはり時代を感じさせる.
関連事項
放射線感受性の修飾
1904年Hahnは,放射線照射中に皮膚を氷で冷やすと皮膚障害が軽減することを報告した[2].1909年Schwarzはラジウム容器で前腕を強く圧迫することで[3],1924年Mottramはラットの尾の血管を結紮することで同様の効果を報告している[4].これらの報告では,皮膚障害が軽減する原因を血流の低下に求めたが,酸素濃度低下との関係について初めて触れたのは,回虫卵の実験に基づく1921年のHolthusenの論文で[5],1923年にドイツのPetryが植物細胞で低酸素状態が放射線抵抗性の原因となること,すなわち酸素効果を初めて確認した[6].1933年イギリスのCrabtreeらは初めて哺乳類の癌細胞で,低酸素により放射線感受性が低下することを示した[7].その後,Readらによる一連のマメ科植物による研究で無酸素状態と有酸素状態の感受性の比が概ね3倍であることが明らかとなった[8,9].
酸素効果の治療応用が試みられたのは1950年代で,100%酸素吸入下[10],高圧酸素室[11],過酸化水素の点滴静注[12]などの有効性が報告されたが,広く臨床に応用されるには至らなかった.
薬剤による放射線治療効果の修飾は,1947年,放射線によるin vitroの酵素反応の抑制効果がSH化合物によって軽減されるという研究を契機として[13],1949年にはシステインを静注したラットで,X線障害による死亡率が低下することが示され,その後グルタチオンなど他のSH製剤も試みられた.逆に放射線の効果を増強する薬剤としてビタミンK(シンカビット)が試みられたが[14],いずれも臨床的有効性は証明されなかった.しかしこれを糸口として,抗癌剤(アクチノマイシンD,5FUなど)の放射線増感作用が知られるようになり,放射線化学療法の研究が開始された.
放射線生物学の発展
1950年代,第二次世界大戦中の原子爆弾開発を目的としたマンハッタン計画の一環として行われた放射線基礎研究の延長として,放射線の生物学的影響を細胞レベルで研究する放射線生物学が発展した.特にコロラド大学のPuckらがヒト細胞培養技術の開発に成功した結果,放射線照射下の細胞生存率曲線を描けるようになったことから多くの知見が得られるようになった[→原著論文].現在の教科書に書かれている基本的な放射線生物学の知識の多くはこの時期に明らかとなったものである.例えば分割照射の理論的背景として,Elkindは亜致死損傷からの回復,いわゆるElkind回復の概念を導入した[→原著論文].ワシントン大学のTolmachは,照射後に細胞を一定の条件,例えば低温,低栄養に置くことによって生存率が上昇する現象を潜在致死損傷(potentially lethal damage)からの回復(PLD回復)により説明した[15].細胞周期と放射線感受性の関係は,1963年にTerasima(寺島東洋三)らのHela細胞の実験で明らかとなった[16].
原著論文
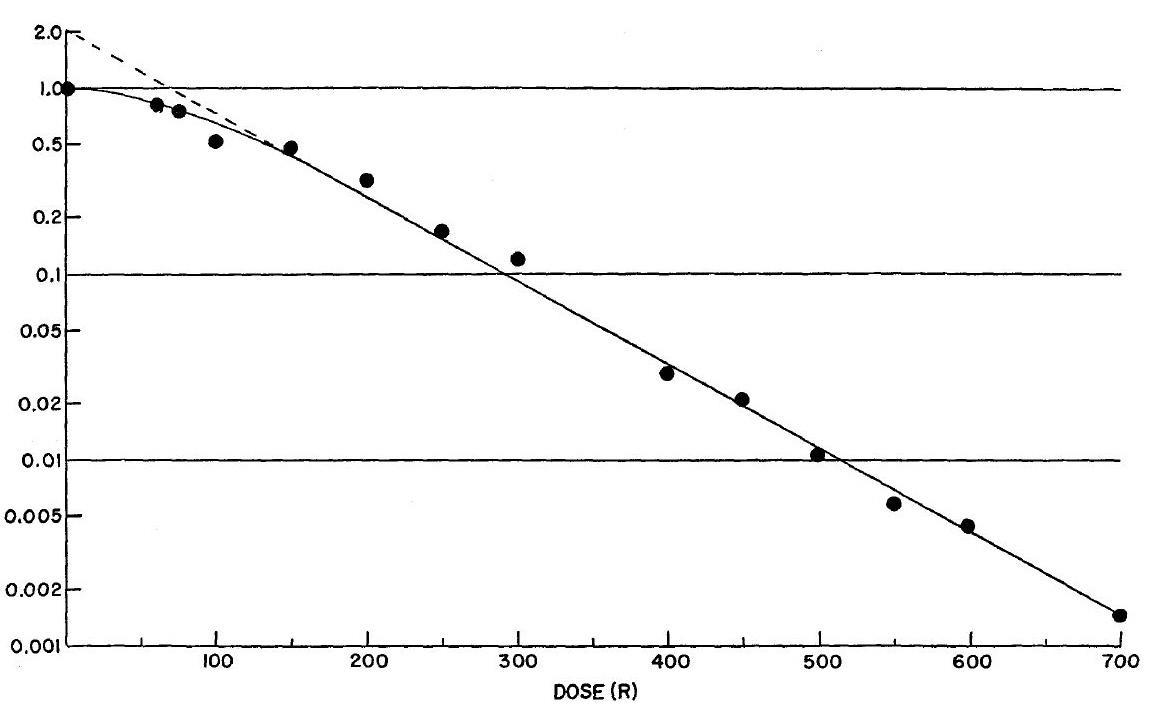
図1. X線照射によるHeLa細胞の生存曲線.75rに肩があり,2ヒットモデルを当てはめることができる.
【要旨・解説】著者のPuck & Marcusはコロラド大学の生物学者で,この直前にヒト子宮頸癌由来のHeLa細胞の細胞培養に成功した[17,18].それまで哺乳類の細胞を細菌のように培養してコロニーをつくる技術がなかったため,放射線の細胞への影響を定量的に研究することができなかった.Puckらはこの技術を応用して,HeLa細胞の細胞感受性を調べ,初めて哺乳類細胞の生存曲線を描くことに成功した.その後の放射線線生物学の発展の原点となった論文である.
培養HeLa細胞にX線を照射すると,照射線量に応じたコロニー形成能の低下,成長遅延が認められる.100rで既に変化があり,低線量では4~5回分裂してから増殖を停止し,多くの巨細胞を含む増殖不全コロニーとなる.600r以上では初回の分裂も障害され,800r以上では単独細胞のままでコロニーを形成しなくなる.従来知られている大腸菌やウイルスでは,このような増殖能の消失を来たす線量が4,000~40,000rであることを考えると,HeLa細胞の放射線感受性は非常に高い.致死的効果の原因は,細胞内の遺伝機構にあると考えられる.細胞生存曲線(図1)は75r付近に肩があり,それ以上の線量についてはD0=96rの対数直線となり,2ヒットモデルを当てはめることができる.
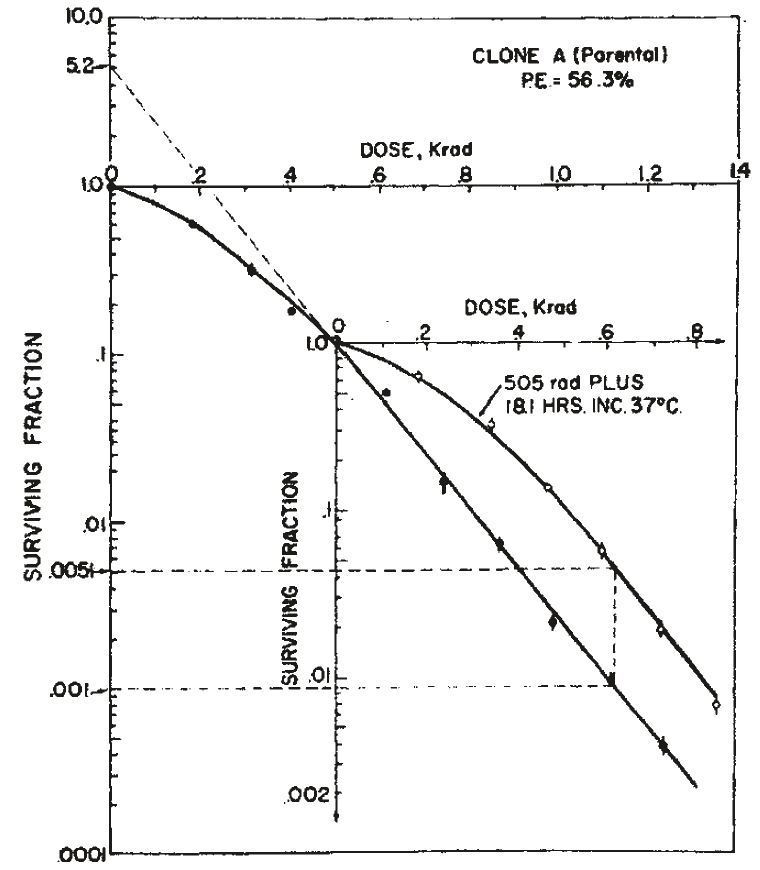
図2. 1回目に505radを照射,18時間後に487radを照射した場合の細胞生存曲線.1回目の照射から完全に回復が見られる.
【要旨・解説】細胞の放射線傷害からの回復を実験的に示したもので,いわゆる Elkind回復の初報である.現在も放射線生物学の教科書に必ず掲載されている回復曲線が提示されている.
Puckらが開発した細胞培養の技術を用いて,チャイニーズハムスターの培養体細胞(卵巣,肺)にX線を照射した.2回に分けて照射を行ない,照射間隔を変えて細胞生存曲線を作成した.37℃の条件下で,細胞は1回目の照射後10時間で完全に回復し,これ以降に照射すると初回と同じ曲線を描くこと,これを何回繰り返しても同様であることが明らかとなった(図2).
放射線治療にあたっては,分割照射による放射線傷害回復があることは臨床的に知られていることであるが,この研究結果はこの現象に生物学的な根拠を与えるもので,今後の研究の方向性を示すものである.
新しい照射装置
超高圧X線

図3. Coolidgeによる3段カスケード管球.900kVの出力が可能だが,長さ3m以上あった[19].
1920年代の「深部放射線治療」に使用された標準的なX線は,200kV程度のCoolidge管であった.理屈の上からは,X線のエネルギーは高いほど透過性が増加し,側方への散乱線も減少するの深部に多くの線量を照射できる.しかしこれ以上の高圧管球の製作は技術的に難しかった(例えば一定の電圧を超えると陰極が加熱されない状態でも電流が流れる冷陰極効果(cold cathode effect)によって管球が破損した[19]).そこで1926年,Coolidgeは複数のCoolidge管を直列に連結し,各段毎に電子を加速するカスケード管球(cascade tube)を作った(図3).1段あたり250~300kV,これを3段重ねたカスケード管球は900kVを出力できたが,長さは3m以上に及んだ.1928年,Lauritsenは変圧機を複数段使用した750kVの装置を作ったが,これを収める部屋は40x20mを必要とした[20].
1930年代にもさまざまな方法で,1MV前後あるいはそれ以上のいわゆる超高圧X線治療(supervoltage therapy)の試みが続いた.具体的には,Cockcroft-Walton装置(コンデンサと整流器を多段接続した電圧増幅機)[21],Van de Graaf装置(ゴムベルトを回転させて静電気を作り絶縁金属求内に蓄電する装置)[22]などで1~2MeVの照射装置が作られた.これらは原子核物理学研究装置の流用であったが,いずれも大型であったり安定性に欠けるなどの理由で広く普及するには至らなかった.
ベータトロン
1940年にイリノイ大学の物理学者Kerstが開発した,交流電磁石による電磁誘導の原理で電子を加速する装置で,1942年にGE社が20MeV装置,その後シーメンス社が45MeV装置を製品化して.高エネルギーX線,電子線治療装置(→関連事項)として長く使用された[23].1970年には世界で200台以上が稼働していたが*,マグネットが重いことからヘッドを回転することが難しくX線量も小さかったことから,やがて直線加速器にとってかわられた.
*日本では,1955年に島津製作所が京都大学(6MeV)に納入し,1975年には国内で50台が稼働していた.
直線加速器(ライナック)
直線加速器の原理は,1924年にスウェーデンの物理学者Isingにより考案され,1931年,カリフォルニア大学のErnest LawrenceがDavid H. Sloanとともに,世界初の30段直線加速器を作って水銀イオンを加速した[7].1930年代以降,核物理学とともに加速器技術は急速に進歩したが,高周波発生装置が未発達であったため電子のような軽い粒子を加速することはできなかった.しかし第二次世界大戦中のレーダー技術開発の産物で高周波発生装置が完成し,1953年にイギリスのHammersmith病院,翌年にはアメリカのStanford大学で治療が開始された.その後4MV装置を中心に多くの実績が蓄積され,それまでのkV級にかわってMV級の直線加速器よる放射線治療が確立し現在に至る本格的な放射線治療の出発点となった*[→原著論文].
*日本では1963年にシーメンス社の装置が国立がんセンターなど3施設に設置され,1966年に三菱電機が初の国産機(6MeV)を国立金沢病院に,1967年に東芝が久留米大学(13MeV)に納入した.現在では約1,000台が稼働している.
遠隔コバルト照射装置
これらと平行して,コバルト(60Co)による治療が発達した.60Coは1941年にサイクロトロンで初めて作られたが,供給量が限られ,反応断面積も小さいことから治療応用は難しかった.しかし1951年,カナダのChalk River原子炉で大量生成に成功し,翌1952年にJohnsがこれを利用した遠隔コバルト照射装置(テレコバルト装置)を開発した[→原著論文] .60Coのγ線は1.17MeV, 1.33MeVと治療に適しており,さらにその後回転型装置も開発されて広く普及したが,半減期5.2年の60Coは,約3年毎に線源の更新が必要となるなど運用上の制約もあり,直線加速器の小型化,普及にともなって衰退した*.
*日本でも1953年に全国7拠点に導入されたのを皮切りに,一時期は数百台が稼働していた.
原著論文
linear accelerator
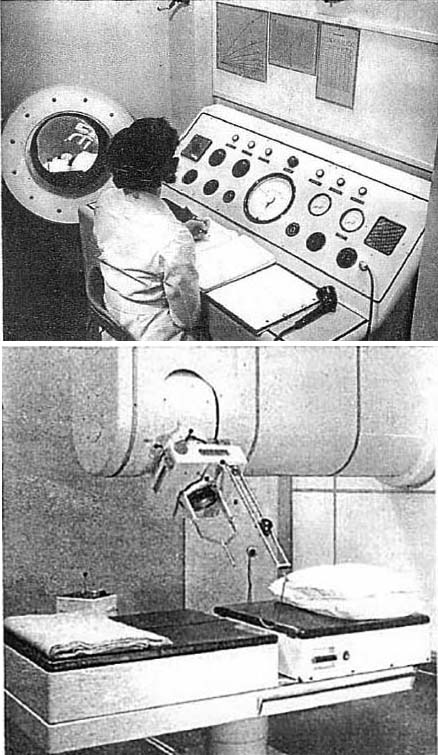
図4. Hammersmith病院に設置された世界初の治療用線形加速器の操作室(上),治療室(下).操作室の壁の丸窓は患者監視用.寝台の上に照射ヘッドが見える.
【要旨・解説】イギリスの医学研究審議会(Medical Research Coucil, MRC)の研究支援によって実現した世界初の臨床用直線加速器の技術的な詳細に関する報告である.MRCは,1913年に医学研究費の効率的な配分を目的として設立された政府機関の外郭団体で,以来多くの重要な研究をサポートしている(フレミングのペニシリン研究,ワトソン,クリックらのDNA研究などもその成果のひとつ).この直線加速器は,ロンドンのHammersmith病院に設置された(図4).
まず冒頭に装置のレイアウトが紹介されており,現代のリナック室とそれほど大きな違いはないが,患者の監視のために大型の鏡を使った潜望鏡のような構造を設けている点はおもしろい.さまざまな計測装置を工夫して,照射されるX線ビームの位置と線量分布の精度を検証しており,現在も使用されている平坦化フィルターの必要性も初めて記載されている.
放射線防護の基本は,厚さ4~6フィートのコンクリート壁で,同階の他の実験室でアイソトープの実験に影響しない程度に十分な防護が達成されているとしている.1953~54年に約400名に,日常診療レベルで治療を行なったとしているが,その治療内容や成績についてはまだ触れられていない.
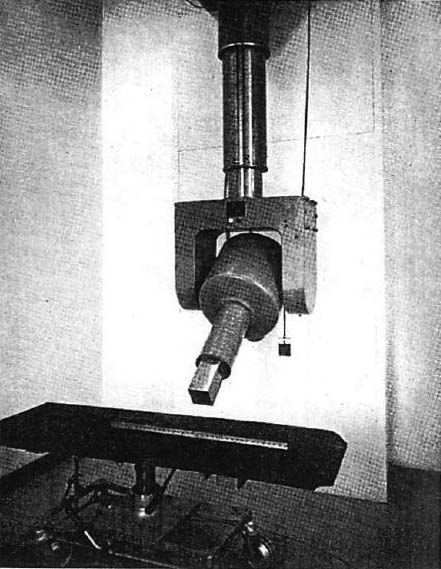
図5. カナダのSaskachewan大学に設置された遠隔コバルト商社装置.
【要旨・解説】カナダで開発された遠隔コバルト照射装置に関する初報である.著者は物理学者で,全4篇 PartⅠ~Ⅳにわけて技術的,物理学的側面が詳述されているが,ここに紹介するPart Ⅰには装置の設計と設置に関して記載されている (Ⅱ~Ⅳは[25-27])(図5).
カナダには,第二次世界大戦中に原爆開発を目的としてチョークリバー研究所に原子炉が建設され,戦後は主に放射性同位元素の研究,製造に利用され,現在も医療用,科学研究用同位体の供給源としては世界最大規模である.本研究は,この原子炉を利用して60Coを製造し,放射線治療装置(テレコバルト)として利用したものである.
線源のコバルトは直径約2.5cmのディスクを25枚重ねたもの(約60g)で,放射能は約1,600Ci (59×1012Bq)である.これを直径約50cm,高さ約50cm,重量1トンの鉛容器内に格納し,線源を収めた筒状の部分を電動ホイールで180度回転させることにより,線源のオン/オフを制御する線源回転方式であった.線量率は1mの位置で約22.8R/分であった.治療室は,厚さ30cmのコンクリート製で,扉が開くと線源がオフになるインターロック機構を備えていた.テレコバルトは,これをプロトタイプとしてさまざまな装置が開発されて急速に普及し,その後直線加速器に置換されるまで活躍した.
関連事項
電子線治療と術中照射
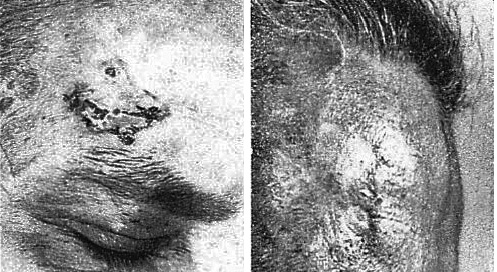
図6.初の電子線による治療.前額部の皮膚癌.左:治療前,右:照射6週後[30]
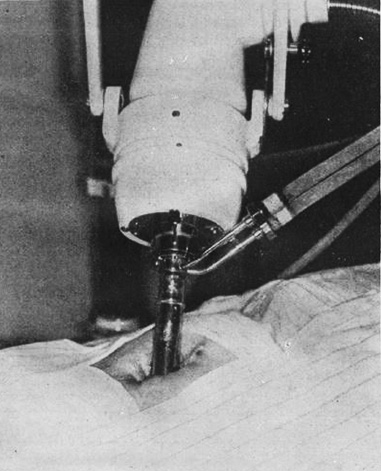
図7. 低電圧近接治療用管球よる膀胱癌の術中(開創)照射[35]
レントゲンによるX線発見のきっかけとなった陰極線の実態が電子であることをイギリスの物理学者J. J. Thomsonが明らかにしたのは,X線発見の翌々年,1897年のことであった.1932年,Glockerは,電子線を人体に照射すると一定の深さで最大となり,それより深部では急速に減少することを明らかにした[28].1940年,アメリカのイリノイ大学で電子線照射装置ベータトロンが開発され[29],1948年,ゲッティンゲン大学のBodeらが,シーメンス社工場内に設置されたベータトロンを利用して皮膚癌の治療を行ったのが電子線の初の臨床応用であった[30](図6).続いてKeppらは外陰部癌に電子線を照射して好成績を報告した[31].その後,治療装置の主流は直線加速器(ライナック)になったが,電子線は表在疾患の治療で一定の評価を得て[32],現在にいたるまで皮膚,乳腺など浅在病変に広く利用されている.
電子線のもう一つの用途が術中照射である[33].1907年にアメリカのBeckは,胃幽門部癌に対して開腹して胃を腹壁に縫い付けて挙上し,病巣に直接X線を照射した[34].これが初の術中照射とされる.当時の低電圧X線管球では皮膚障害を来たさずに深部病変を治療することが難しかったため,深部照射法のひとつとして考案されたもので,術中照射というより開創照射というべきものである.その後1939年にLevineが膀胱癌の開創照射を報告[35]して以来,膀胱癌に対する開創照射が一時期注目された(図7).当時の照射方法は50~60kVの低電圧近接治療用管球を使用して,数日間,数回~20回の分割照射であった[35,36].高線量1回照射による本来の意味での術中照射の嚆矢は,1953年,ドイツのBarthの報告[37]で,初めて「術中」 という表現を使用したのもBarthであった[38].
現在に至る超高圧照射装置による術中照射は,1963年,国立がんセンターで開始されたベータトロンを利用した電子線照射に始まる.第1例は膵癌であったが,その後も主な対象は膀胱癌[39],膵癌[40]であった.これに触発されて1976年にアメリカでも直線加速器による電子線術中照射が開始され[41],その後各国で様々な試みが続いている.術中照射は,切除不能あるいは全摘不能の進行癌の姑息治療,切除可能癌の機能温存治療あるいは補助治療として行われる.前者の例として,膵癌,胆道癌,後者の例として頭頸部癌,乳癌*などがある.装置,設備の制約から施行可能な施設は限られ,また施設によって術式,照射方法が異なり広く普及するには至っていないが,特に日本では研究が盛んである*[42].
* 最近では,乳癌術後の標準治療とされる全乳房照射にかえて,短期間で行う乳房部分照射(加速乳房部分照射, accelerated partial breast irradiation, APBI)が注目されており,そのひとつの方法として術中照射による単回照射が検討されている[43].
出典
- 1. Seitz S, Winz H. Unsere Methode der Röntgen-Tiefentherapie und ihre Erfolge. (Urban & Schwarzenberg, Berlin, 1920)
- 2. Hahn R. Ein Beitrag zur Röntgentherapie. Fortschr Röntgenstr 8:120-1,1905
- 3. Schwarz G. Über Desensitilisierung gegen Röntgen- und Radiumstrahlen. Münch Med Wochenschr 56:1217-18,1909
- 4. Mottram JC. On the skin rcactions to radium exposure and their avoidance in therapy: an experimental investigation. Brit J Radiol. 29:174-80,1924
- 5. Holthusen H. Beiträge zur Biolgie der Strhalenwirkung. Untersuchungen an Askarideneiern. Pflügers Arch Ges Physiol 187:1-24,1921
- 6. Petry E. Zur Kenntnis der Bedingungen der biologischen Wirukung der Röntgenstrahlen. Biochem Zschr 135:353-83,1923
- 7. Crabtree HG. Action of radium on cancer cells: Some factors affecting susceptibility of cancer cells to radium. Porc Roy Soc (London, Biol) 113:238-50,1933
- 8. Gray LH, Read J. The effect of ionizing radiatons on the broad bean root. Br J Radiol 14:11-16;15:39-42,72-76,320-36,1942;24:572-622,1951
- 9. Thoday JM, Read J. Effect of oxygen on the freaquency of chromosome alterations produced by x-rays, Nature 160:608,1947;163:133-4,1949
- 10. Hutborn KA, Forssberg A. Irradiation of skin tumors during pure oxygen inhalation. Acta Radiol 42:475-84,1954
- 11. Churchill-Davidson I, Sanger C, Thomlinson RH. High-pressure oxygen and radiotherapy. Lancet 1:1091-95,1955
- 12. Mallams JT, Finney J, Balla GA. The use of hydrogen peroxide as a source of oxygen in a regional intra-arterial infusion system. South Med J 55:230-2,1962
- 13. Dale WM. Action of radiation on aqueous solutions: Experimental work with enzymes in solution. Brit J Radiol. (Suppl)1:46,1947
- 14. Mitchell JS, Simon-Reuss I. Combination of some effects of x-radiation and a synthetic vitamin K substitute. Nature 160:98-9,1947
- 15. Phillips RA, Tolmach LI. Repair of potentially lethal damage in x-irradiated Hela cells. Rad Rees 29:413-32,1966
- 16. Terasima T, Tolmach LJ. X-ray sensitivity and DNA synthesis in synchronous populations of Hela cells. Science 140:490-2,1963
- 17. Puck TT, Marcus PI. A rapid method for viable cell titration and clone production with hela cells in tissue culture: the use of x-irradiated cells to supply conditioning factors. Proc Nat Acad Sci 41:432-7,1955
- 18. Puck TT, Marcus PI. Clonal growth of mammalian cells in vitro - Growth characteristics of colonies from single hela cells with and without a "feeder" layer. J Exp Med 103:273-83,1956
- 19. Coolidge WD. Cathode-ray and roentgen-ray work in progress. AJR 19:313-321,1928
- 20. Lauriste CC. A new high potential x-ray tube. Phys Rev 32:850-857,1928
- 21. Cockcroft JD, Walton ETS. Experiments with high velocity positive ions. Proc Royal Soc A136:619-30, A137:229-42,1932
- 22. Dresser R, Trump J, Van de Graaff RJ. The production of supervoltage Roentgen rays by means of an electrostatic generator. Am J Roentgenol 38:758-61,1937
- 23. Harvey RA, et al. Betatron cancer therapy. Radiology 58:23-34,1952
- 24. Sloan DH, Lawrence EO. The production of heavy high speed ions without the use of high voltage. Phys Rev 38:2021-32,1931
- 25. Johns HE, et al. 1000 Curie cobalt units for radiation therapy. II. Depth dose data and diaphragm design for the Saskatschewan 1000 Curie cobalt unit. BJR 25:302-9,1952
- 26. Green DT, et al. 1000 Curie cobalt units for radiation therapy. III. Design of a cobalt 60 beam therapy unit. BJR 25:309-313,1952
- 27. Dixon WR, et al. 1000 Curie cobalt units for radiation therapy. IV. Radiation measurements with the Eldorado cobalt 60 teletherapy unit. BJR 25:314-318,1952
- 28. Glocker R. Die Energieverstellung im Inneren eines von schnellen Kathodenstrahlen durchseszten festen Körpers. Physik Ztschr 35:774-8,1934
- 29. Kerst DW. The betatron. Radiology 40:115-20,1943
- 30. Bode H, et al.Elektronentherapie menschlicher Hautkarcinome mit einem betatron von 6 millionen elektron-volt. Strahlentherapie..81:251-66,1950
- 31. Kepp RK, Paul W, Shcmermund HJ. Neue Methoden in der Behandlung der Vuvarkarzinome. Geburtshilfe Frauenheilkd 11.298-312,1951
- 32. Smedal MI, Johnson DO, Salzman FA et al. Ten year experience with low megavolt electron therapy. Am J Roentgenol 88:215-28,1962
- 33. 中野政雄. 術中照射と術式変遷の経緯. 最新医学 41:1459-67,1986
- 34. Beck C. On external roentgen treatment of internal structures(eventration treatment). NY Med J89:621-622,1909
- 35. Levine SC, Pack GT, Gallo JS. Intravesical roentgen therapy of cancer of the urinary bladder. J Am Med Assoc 112:1314-17,1939
- 36. Goin LS, Hoffman EF. The use of intravesical low-voltage contact roentgen irradiation in cancer of the bladder. Radiology 37:545-9,1941
- 37. Barth G. Erfahrungen und Ergebnisse mit der Nahrbestrahlung operativ freigelegter Tumoren. Strahlentherapie 91:481-527,1953
- 38. Barth G, Meinel F. Intraoperative Kontakttherapie in den grossen Körperhönlen.Strahlentherapie 109:386-395,1959
- 39. 御厨修一,中野政雄他. 泌尿器科領域の電子線治療. 癌の臨床 12:512-8,1966
- 40. Nishimura A, Iwasaki Y. Intraoperative radiotherapy for advanced carcinoma of the pancreas. Cancer 54:5375-84,1984
- 41. Goldson A L:Preliminary clinical experience with intraoperative radiotherapy. J Natl Med Assoc 70:493-495,1978
- 42. 梅垣陽一郎. 癌治療における術中照射の意義と問題点. 最新医学41:1502-05,1986
- 43. 澤木正孝. 加速乳房部分照射APBIの現状-術中照射. 乳癌の臨床 30:27-25,2015
