- 粒子線治療
- 速中性子線
- 原著論文
- 1937 中性子線治療の可能性
- 1948 中性子線治療の臨床成績
- 熱中性子捕捉療法
- 原著論文
- 1936 中性子捕捉療法の提案
- 1954 中性子捕捉療法の初報
- π中間子線
- α線・陽子線
- 原著論文
- 1946 陽子線治療の提案
- 重粒子線
- 原著論文
- 1982 重粒子線治療の放射線生物学的基礎
粒子線治療
速中性子線
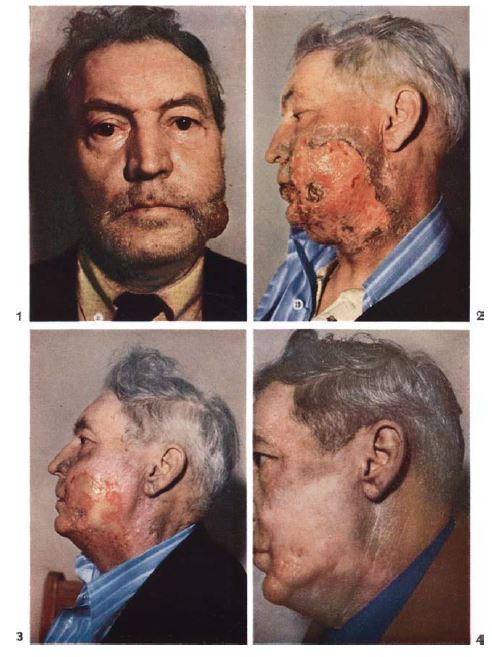
図1. 頬粘膜扁平上皮癌の皮膚,下顎浸潤例の速中性子治療例.1:治療前,2: 隔日照射,照射野10×10cm,815r照射後.3: 55日目.治療終了の2日前.4: 治療15.5ヵ月後.腫瘍は消失した[1].初期には一部の症例に著効して期待が高まったが,最終的には有効性が示されなかった.
光子,電子よりも重い粒子を利用する粒子線治療として,先ず最初に試みられたのが速中性子線治療である.1932年に世界初のサイクロトロン(直径10インチ)を製作したカリフォルニア大学放射線研究所(後にLawrence Berkeley National Laboratory, LBL)の物理学者Ernest O. Lawrenceは,当初からその医学利用にも力を注ぎ,弟の医学者John H. Lawrenceとともに1936年にはサイクロトロン(37インチ)で作った24Na,32Pによる白血病治療を試み,さらに同年末の北米放射線学会(RSNA)でサイクロトロンから得られる速中性子線による放射線治療のアイデアを提案した[→原著論文].初めてこれを臨床に応用したのはカリフォルニア大学の放射線科医Robert Stone*らで [1],1942年,医療用サイクロトロン(60インチ)を使って頭頸部,皮膚,消化管,前立腺などの癌120例を治療して17%に腫瘍の完全消失,48%で部分消失を報告した(図1).第二次世界大戦の最中,サイクロトロンが原爆開発を目的とするマンハッタン計画に占有されて研究は一時中断したが,その後再開され,1948年に報告された226例の遠隔成績では,一定の腫瘍には著効したものの全体としてX線に対する優位性がなく,長期生存例全例に重篤な晩期障害が発生するなど否定的な結論に終わった[→原著論文].
*Lawrence兄弟の母,Gunda Lawrenceは,1937年に子宮癌で余命3ヵ月と宣告されたが,兄弟は共同研究者の放射線科医Dr. Stoneに治療を依頼した.Stoneは深部X線照射による治療に成功し,Gundaはその後15年存命して83歳の天寿を全うした[2]
しかしこの時期,放射線生物学の研究が進み,放射線感受性が組織酸素分圧に依存し,低酸素状態の細胞は感受性が低いことが明らかとなり[3,4],癌組織の内部に低酸素細胞が多いことがX線治療に対する抵抗性の原因のひとつと考えられた.また放射線感受性と細胞周期の関係が知られるようになり[5],癌組織内の細胞周期の分布も治療抵抗性の一因と考えられた.これに対して,速中性子線のような高LET放射線の治療効果は,X線にくらべ酸素濃度,細胞周期への依存性が少ないことが示された.
このような生物学的理論を背景として,1965年,イギリスのHammersmith病院で再起を期して速中性子照射が再開され,頭頸部腫瘍についてかなり有望な初期成績が報告された[6].日本でも1969年に放射線医学研究所で本邦初の粒子線治療としてvan der Graaf装置による速中性子治療が開始され[7],1975年には初の医用サイクロトロンが設置された.その後約20年間にわたり世界各地の21施設で1万5千例の治療が行われたが,唾液腺癌,前立腺癌,骨軟部肉腫に有効性が証明されたものの当初期待されたほどの成績は得られず[8,9],速中性子線治療は1990年代に終焉を迎えた.
原著論文

図2. Lawrenceが設計,製作したサイクロトロン全景.重陽子を加速してベリリウムのターゲットに照射して中性子線を発生した.
【要旨・解説】 サイクロトロンの発明者であるカリフォルニア大学の物理学者ローレンス(Ernest O. Lawrence)が,中性子線の生物学的作用について,北米放射線学会で講演した記録である.著者自身は医師ではないので医学的な内容についてはぎこちない表現も散見されるが,全米の放射線科医に向けて中性子線の医学応用の可能性について述べたこの講演をきっかけとして,中性子線治療の試みが開始されることになった.
実際の実験は,放射線科医である弟のJohn H. Lawrenceら医学者が行ったもので,ここではその研究成果を紹介する形になっている.具体的な実験内容は,ラットの全身照射による致死線量の測定,ショウジョウバエの卵の致死効果,小麦の未生,シダ胞子の成長抑制効果,マウスに移植したヒト乳癌および肉腫に対する細胞致死効果である.そのいずれにおいても,中性子線はX線に比べて生物学的効果が大きかった.例えば移植乳癌に対する効果は,X線の5.1倍であった.このことから,中性子線が医学的に非常に重要な意味を持つとして,治療への応用の可能性を示唆している.
中性子発生装置は,自ら設計,製作したサイクロトンで(図2),重陽子をベリリウムのターゲットに照射して発生する(d, n)反応により速中性子を取りだしている.それまでの中性子の発生方法は,主にRaやRnから発生するα線をベリリウムに衝突させる(α, n)反応を利用するもので,サイクロトロンの登場によりはじめて速中性子線を安定的にとりだせるようになった. 装置が大型,高価であることが医学応用を妨げる懸念については,実際にはそれほどではなく,今後医用装置を現在開発中であると結んでいる.
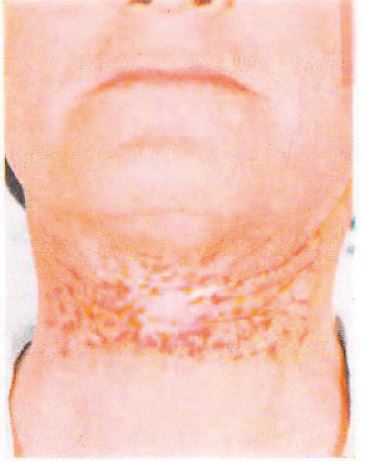
図3. 喉頭癌の中性子線治療5年後.側方対向2門.斑状の萎縮性皮膚,皮下脂肪織の消失,瘢痕部の収縮が認められる.
【要旨】中性子線の絶対的な線量計測法は存在しないことから,標準的なVictoreen線量計を使用し,その示度を任意単位nとして,物理学的な計測から 1n = 2.5 rep (roentgen equivalent physical)とした.生物学的な作用についてはウサギやマウスの実験から 1n = 4rと考えたが,実際にはもっと大きかった.これを知っていれば臨床応用を開始することはなかったであろう.
カリフォルニア大学の8eVサイクロトロンで24例,その後16MeVサイクロトロンで226例の患者を治療した.対象疾患は全身の癌で,いずれも既にX線照射,ラジウム治療などを受け,治癒困難あるいは再発例である.死亡例,生存例をふくめ,中性子線によりほとんどの例で癌が消失しており,癌に対する有効性はあると考えられる.しかし中性子線の早期反応,晩期反応はX線よりも強く,特に晩期反応は予想を上回る高度なものであった(図3).1948年の時点で18例が長期生存しているが,全例で皮膚障害(表皮壊死,萎縮,硬結,変形),骨障害(顎骨壊死,骨炎),失禁など,苦痛を伴う障害が発生し,12例では日常生活を営めなかった.中性子線治療は継続すべきものではなく,今後陽子線,高圧β線,X線などの治療応用にも警鐘を鳴らすものである.
【解説】 カリフォルニア大学の放射線科医Robert S. Stoneによる,世界初の速中性子線治療の成績報告である.戦時中のことで,研究者が徴兵され,途中でサイクロトロンがマンハッタン計画に占有されて使えなくなるなど,厳しい環境下での研究であったが,本稿でも断わっているように,部位別の症例数は少なく,また照射線量,照射方法もまったく不統一で,必ずしも科学的な内容とはいえない.しかしその結論はきわめて否定的なもので,中性子線治療は,腫瘍制御という点ではX線と同程度あるいはそれ以上の効果があるが,副反応,特に晩期副反応が著しく大きいことから,これ以上継続するべきではないという結論に達している.
本稿は,米国ラジウム学会におけるJaneway Memorial Lecture をまとめたものであるが,通常このような記念講演は,特定の分野の過去をレビューしつつ,その明るい将来展望で締めくくるのが一般的である.これほどまでに,まさに取り付く島もないほど否定的な内容は,きわめて例外的である.著者の中性子線治療に対する反省と,後進への警告の思いが,それほど強かったことの表れなのであろう.
この論文により,速中性子線治療はいったん打ち止めとなった.1970年代に再開され,副作用の問題は解決したものの,結局X線を上回る成績が得られずに終焉を迎えることになった.
熱中性子捕捉療法
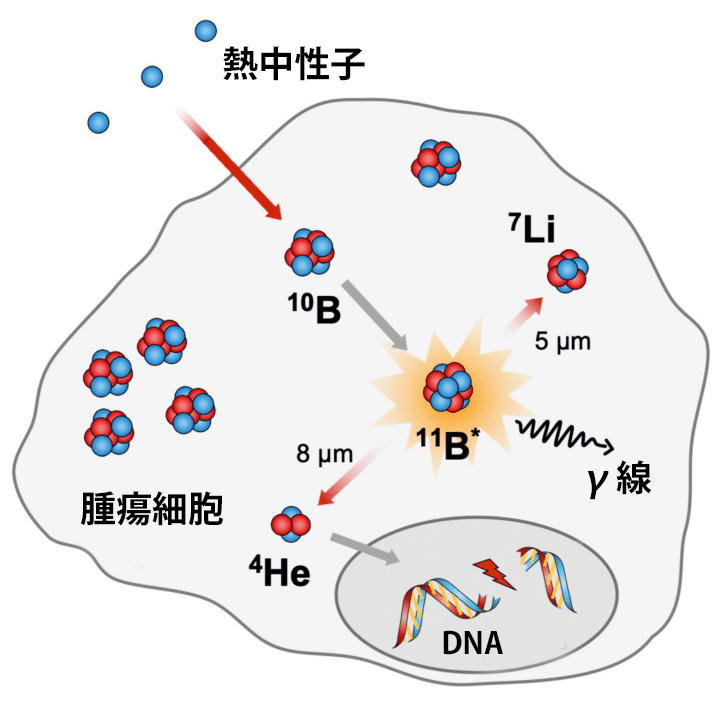
図4. 中性子捕捉療法.腫瘍細胞に選択的に取り込まれた10Bから核反応により4He(α粒子)と7Liが放出され,DNAを障害して細胞殺傷作用をもたらす.いずれも飛程が短いことから周囲組織への影響がほとんどない[17].
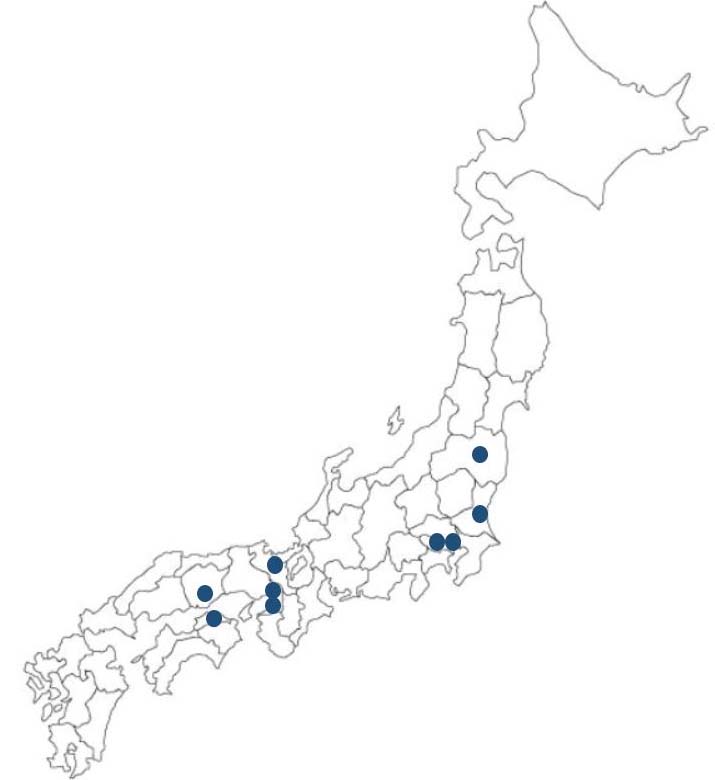
図5. 国内の中性子捕捉療法施行施設(導入計画中施設を含む)[27].
運動エネルギーが小さく低速の熱中性子*は,それ自体は透過性に乏しいが様々な核反応を引き起こす.これを治療に利用するアイデアを最初に提唱したのはLocherであった[→原著論文].ホウ素中性子捕捉療法(BNCT, boron neutron capture therapy)は,核反応
しかし当時BNLに留学していた畠中坦(帝京大学脳神経外科)が帰国後に,新たなホウ素化合物BSH(
しかし運用上最大の難関は中性子源として原子炉が必要なことであった.そこで1990年代から加速器を利用して核反応
* 熱中性子:低速で運動エネルギーが小さい(0.025eV程度)中性子.速中性子(0.1~0.5MeV以上)が物質中の原子核と衝突してエネルギーを失い,最終的にその物質の熱分子運動と平衡に達した状態の中性子を指す.熱中性子は,様々な原子核と反応して別の原子核を生み出す核反応(吸収,核分裂,散乱)を起こしやすい.熱外中性子は,熱中性子より運動エネルギーがやや大きい(0.5~10eV)領域を指す
** Bは中性子と核反応を起こしやすい(=反応断面積が大きい)ことから,原子炉の制御棒に使用される.
原著論文
【要旨】中性子は電荷をもたないため,原子核に容易に進入し,原子核壊変など様々な反応を起こす.中性子の生物学的作用は主に水素原子による吸収で,実際には弾性散乱が大部分を占め,中性子のエネルギーの63%が水素に移動する.水素は生体内に広く存在することから,組織全体にエネルギーが付与される.一方,リチウム,ホウ素など水素よりも重い元素は,水素よりも多くのエネルギーを吸収してα線を放出する.
そこで,医学応用の可能性として,注射などの方法で組織にこのような重い元素を含む無毒の物質を投与しておけば,中性子が選択的に吸収され,放出されるα線により癌を治療できる.あるいはこのような物質を感染巣に集中させることにより,病原菌を死滅させることができるかも知れない. 中性子線の発生には,ラジウム,ラドンの放出するα線をベリリウムに照射する,硬γ線をベリリウムに照射する,Van de Graaf装置のような高電圧発生装置を使用する,サイクロトロンを使用する方法などがある.計測法,フィルター法についても様々方法があり,なお今後の検討が必要である.
【解説】著者はペンシルベニア大学の物理学者で,遅速中性子(熱中性子)の物理学的,生物学的特性を要約し,その医学応用の可能性を示唆している.特に,現在の熱中性子捕捉療法の可能性をいち早く指摘している点で画期的な論文である.1932年に中性子が発見されたわずか4年後に,その生物学的作用を現在の知識からみてもほぼ正しく分析し,医学応用の道を示唆した洞察力は注目に値する.
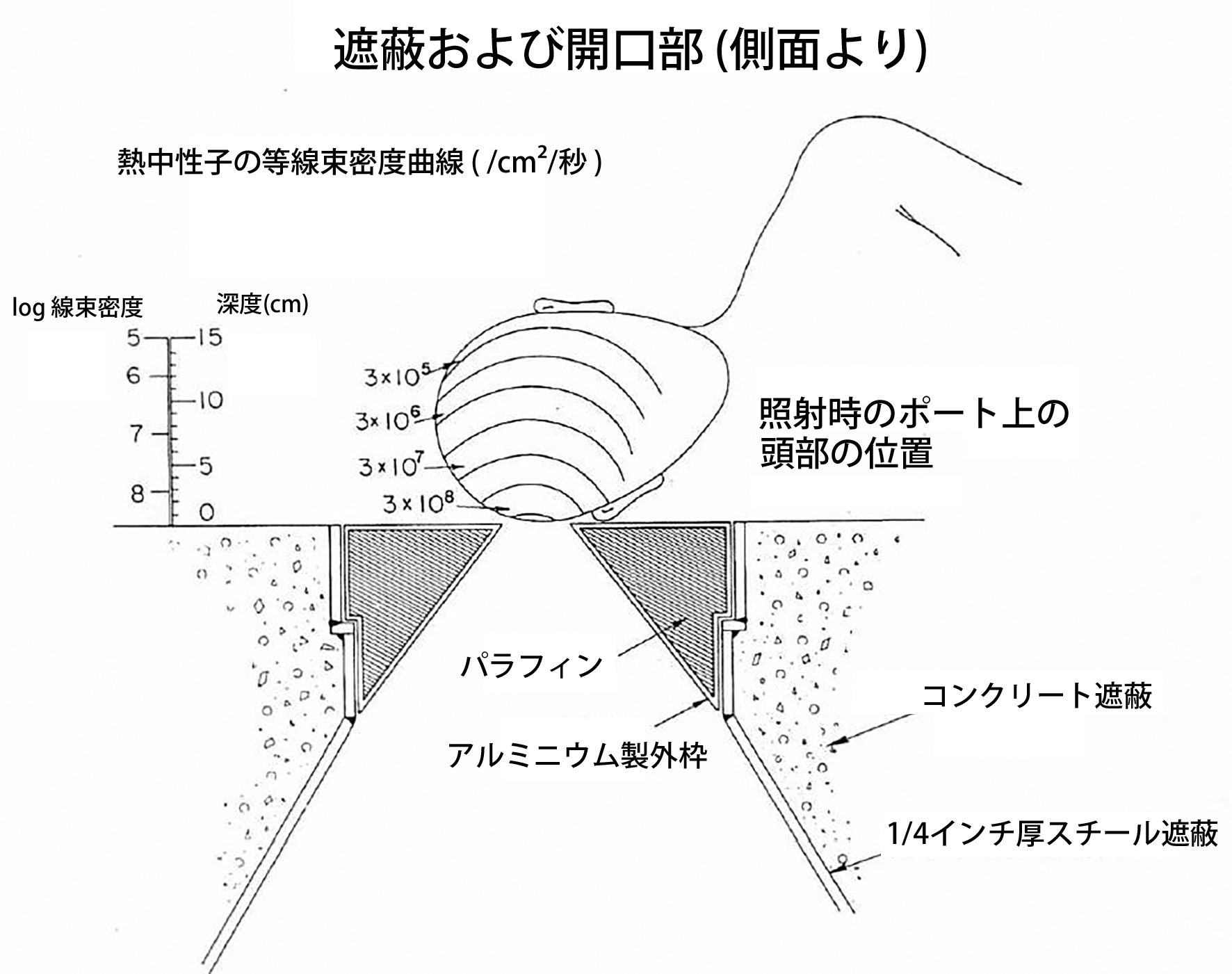
図6. 中性子線の照射法と線量分布.図の下部は原子炉そのもので,天井に開けた径10cmの照射口の上に側頭部をあてて照射する..
【要旨】膠芽腫と診断された術後10症例に,ホウ素熱中性子捕捉療法を施行した.熱中性子は,ブルックヘヴン国立研究所の原子炉を利用し,中性子捕捉元素には濃縮ホウ素(B10)から生成したホウ酸を使用した.装置の構造は,原子炉の天井部分の遮蔽ブロックを一時的に取り外し,そこにあけた径10cmの照射口に側頭部を密接させるという,甚だプリミティブなものである(図6).ホウ酸の腫瘍への集積は,膠芽腫が血液脳関門を欠くことを利用にしており,中性子照射によって正常血液脳関門に影響がないことを動物実験で確認した.静注10~12分後から原則として40分照射した.初期の5例は1回照射,後半の5例は5~6週間隔で2~4回照射した.
1回照射した5例の経験から,複数回の照射が必要と考えられた.全21回の照射で,確実な症状の改善は8回,不確実な改善は5回,変化無しが7回であった.報告の時点で,全例が死亡している.最長観察期間は初回照射から186日であった.合併症は,照射野の皮膚症状のみで,重篤なものは見られなかった.今後さらに症例を重ねて検討する妥当性があると考えられた.
稿末の討論では,照射量が不充分であることが指摘されており,改善策として,速中性子を含めることが提案されているが,既に速中性子線は晩期副作用が強いことから,ホウ素投与量をさらに増やす方べきであるとしている.
【解説】ホウ素熱中性子捕捉療法を初めて臨床応用した報告である.その理論については,1936年にLocherが提案していたが,第二次世界大戦をはさんで,充分量の熱中性子を供給する手段として原子炉が利用できるようになり,ようやく臨床応用が可能となった.術後の画像診断(気脳撮影)は行われていないが,全10症例の一部で照射直後にある程度の神経症状の改善が得られている.生命予後については他の治療法との記載がないが,大きな改善はないようである.
本稿の結論として,さらに臨床例を重ねることが妥当であるとしているが,これに続く臨床成績も従来の治療法を上回るものではなく,1961年には中断されるに至り[10,11],1975年に日本の畠中らが新たなホウ素製剤を開発するまで日の目をみることはなかった.
π中間子線
1935年に湯川秀樹がその存在を予測,1947にPerkinsによって発見されたπ中間子(pion)は,陽子と電子の中間の質量を持つ粒子である.軽いためにそれ自体の生物学的効果は小さいので浅在組織の障害は少ないが,飛程終末でBragg peakを形成して深部組織の原子核を核分裂させ,生物学的効果の大きい陽子,中性子,α粒子を放出する.
このことから原理的には優れた治療効果が期待され,折しも速中性子線や熱中性子捕捉療法の成績に失望が広がっていた時期でもあり,これに替わる治療法として注目された.しかし,1970~80年代にアメリカ,カナダ,スイスの3施設で,巨大な装置を使用して行われた脳腫瘍,前立腺癌などを対象とする臨床試験で従来の光子線以上の成績が得られず,90年代半ばに中止された[18,19].
α線・陽子線
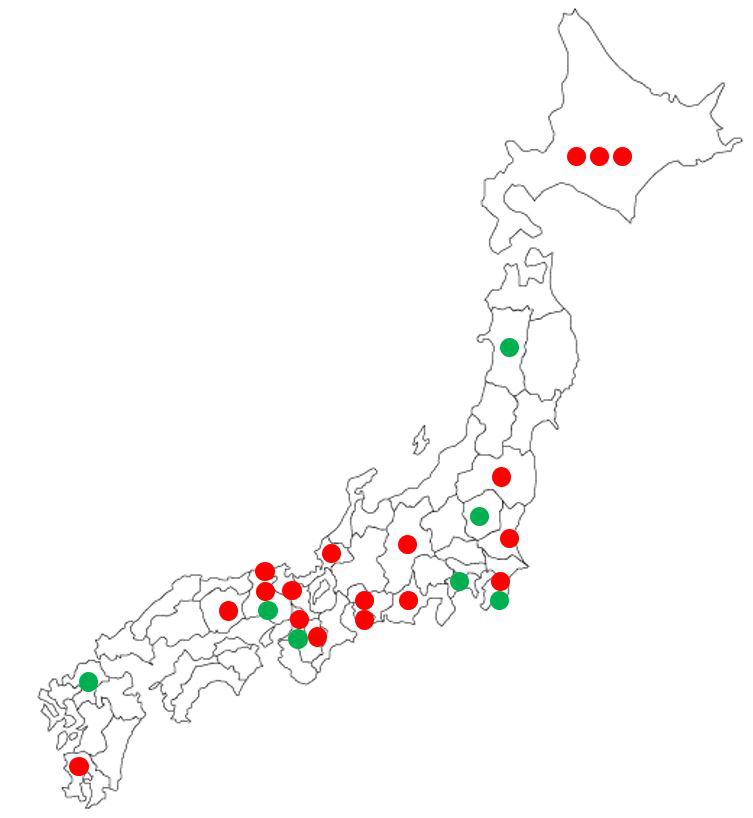
図7. 国内の粒子線治療施設(●陽子線 20施設,●重粒子線 7施設)2024年現在[27].日本は世界で最も粒子線治療施設が多く,実績豊富である.
1904年,オーストラリアの物理学者Braggらは,荷電粒子を組織に入射すると飛程の終末に幅広いピークを形成することを発見した[20,21],これはその後Bragg peakと呼ばれるようになった.1946年,アメリカの物理学者Wilsonがこの特性を生かして陽子線を放射線治療に応用するアイデアを提唱し[→原著論文],1952年に Tobias らが動物実験で重陽子線,α線の有効性を確認し[22],1954年からカリフォルニア大学で下垂体腺腫を対象とするα線治療が開始された[23].さらに1961年からマサチューセッツ総合病院で,眼球悪性黒色腫,次いで頭蓋底腫瘍の陽子線治療が行われた[24].1973年にX線CTが登場し,線量計算が容易となってBragg peakをより有効に活用できるようになった.
日本では,1979年に放射線医学研究所,1983年に筑波大学で陽子線治療が開始された.放医研の装置はそれまで速中性子線治療に使用されてきた比較的低エネルギー(70MeV)のサイクロトロンの転用で,ほとんどが眼球悪性黒色腫の治療に利用されたが,筑波大学の装置(250MeV)は深在性の腫瘍も適応となりその後の陽子線治療の発展を担うものであった.
これに先立つ速中性子,熱中性子,π中間子などの臨床成績が予想外に振わなかったこともありその再起をかけて,眼球悪性黒色腫,頭蓋底腫瘍などある程度有効性が確認されていた対象疾患に集中して治療が行われた結果,1991年に報告された日本を含む11施設,約12,000例の治療成績総括では,眼球悪性黒色腫の制御率96%,頭蓋底軟骨肉腫,脊索腫で76%という好成績が報告された[24].その後も各国で臨床データが蓄積され,現在では眼球,脊椎,頭蓋底,肝細胞癌,小児癌などに適応が拡大され[25],粒子線治療としては最も実績豊富な手法となっているが,光子線治療に対する優位性についてはなお議論が続いている[26].2024年の時点で国内では18施設が稼働しており[27](図7),頭頸部癌,前立腺癌,骨軟部癌,小児固形癌については保険適用となっている.
原著論文
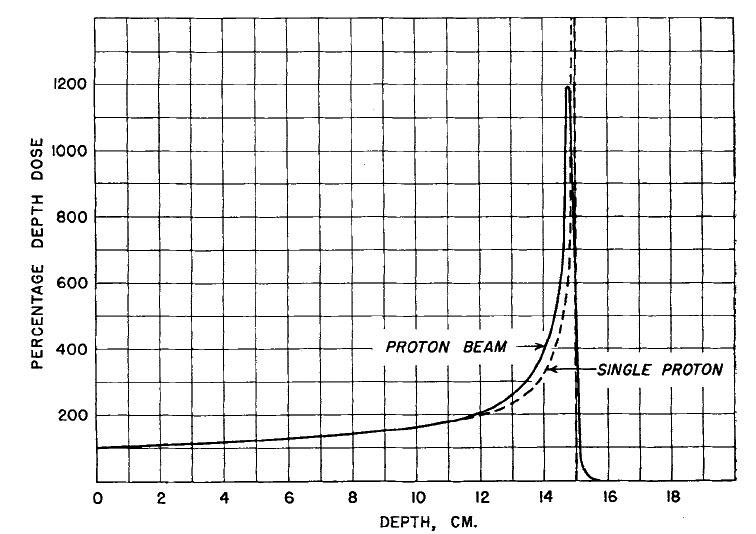
図8.陽子線の表面からの飛程(横軸)と線量(縦軸)の関係.飛程の最後の部分で線量が急増し,入射直後の数倍に達する.このBragg peakを利用して,皮膚に障害を与えることなく深部病変を治療できる可能性を示した.
【要旨・解説】著者は,ハーバード大学の物理学者で,医師に向けて陽子線の特性を説き,その医学応用の可能性を提唱した初の論文である.
陽子は組織内をほぼ直進してやがて停止するが,組織に与える電離量は,飛程の最後の部分では最初の部分の数倍も大きい.これは1904年にBraggらが発見したいわゆるBragg peakと呼ばれる特性であるが,これを利用すれば,皮膚線量を最小限にして体内の限局した領域に集中して照射できることを紹介している(図8).組織の組成を仮定することにより,陽子線のエネルギーと深度の関係を計算で求めることができる.
またこれを一般化することにより,重陽子,α粒子についても同様の効果が期待でき,特に比電離の大きいα粒子は有望であるとし,さらに炭素原子核についもいずれ治療に利用されるかも知れないと結んでいる.
重粒子線

図9. BEVALAC全景.上部の線形加速器(HILAC)で加速された粒子が,下部のまるいシンクロトロン(Bevatron)に入射し,生成された炭素,ネオンなどの重粒子を左側の治療棟で利用する[32 ].2012年に解体された.
初期から陽子線治療を行っていたカリフォルニア大学(LBL)では,1957年に加速器の改修による出力増強に伴い,技術的な理由からHe線に移行し,眼球悪性黒色腫の治療に好成績を収めた.1971年に大型加速器BEVALAC*(図9)が導入され,Heより重いC, Ne, Si, Arなどの重イオンが利用できるようになった.このような重粒子線は,陽子線と同様Bragg peakを持つだけでなく,最終飛程でのLETが非常に大きいことから,強力な治療効果が期待できる.放射線生物学的な実験からも,重粒子線は酸素分圧,細胞周期の影響を受けにくいことが確認された.一般に重い粒子ほど生物学的効果は大きいが,線量分布と生物学的効果のバランスからNeやSiが最適と考えられた[→原著論文][28].その後LBLではNe線が使用され,1993年に施設の老朽化で稼働停止するまで治療が行われ,唾液腺,副鼻腔,前立腺などに有効性が認められた[29].
* BEVALAC: 1954年に同研究所で稼働を開始し,数々の素粒子物理学の発見に貢献したシンクロトロン Bevatron (Billions of eV synchrotron)は1970年代初頭にはその役目を終えつつあったが,1974年,HILAC (Heavy Ion Linear Accelerator, 重粒子線形加速器 ,1971年に稼働)と組み合わされてBEVALACとして再生,延命した.これはHILACで加速された原子核をBevatron内でさらに光速近くまで加速するシステムで,これによりさらなる高エネルギー物理学の研究成果が生み出されたと同時に,医用応用の研究が進められた.1993年に老朽化にともない稼働停止,2012年に解体が完了した.
1994年,日本の放射線医学研究所に医療専用の重粒子線形加速器(HIMAC)が導入され,世界に先駆けて炭素イオン線による治療が開始された.1997年にはドイツ(ダルムシュタット)にも導入され,現在では国内で7施設(図7),国外で8施設が稼働している [27].これらの施設で全身の悪性腫瘍について知見が蓄積されつつあり[30,31],頭頸部,前立腺,骨軟部については保険適用となっている.
原著論文
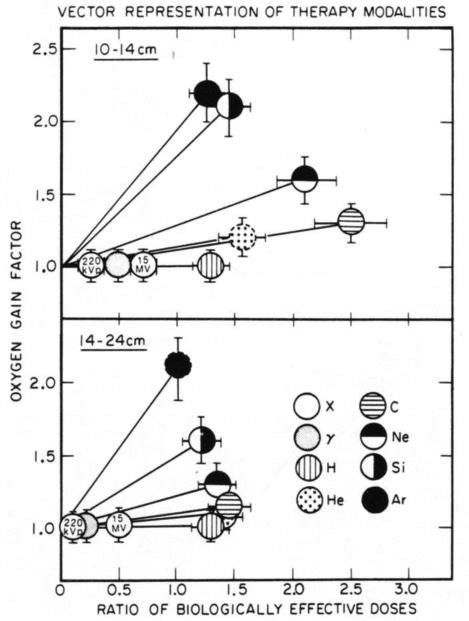
図10. X線(〇)やγ線(●)にくらべてアルゴン(●),ネオン(◓)などの重粒子は,実効線量(横軸),酸素効果(縦軸)ともに優れている.
【要旨】ローレンス・バークレイ研究所のBEVALAC*から得た炭素,ネオン,シリコン,アルゴンの粒子線による生物学的基礎実験を行った.いずれも拡大Braggピークを適切に設定することにより,深在腫瘍に選択的な照射が可能である.冒頭に3つの設問が掲げられ,それに対する解答を実験結果を援用して述べている.
1. いずれの重粒子線が酸素効果,線量分布の観点から最適か:高LET線の放射線生物学的特徴は,RBE,OERに優れていることである.酸素効果は原子番号が大きいほど向上するが,同時にフラグメンテーション(原子核破砕)による二次粒子線が増加して線量分布が劣化することから,腫瘍の位置や大きさによって最適な粒子が異なる.比較的浅い腫瘍にはアルゴン,深部にはネオンが適しており,シリコンは最もバランスが良い(図10).
2. 重粒子線の治療上問題となるその他の生物学的特性はなにか:重イオン線はX線に比べて,酵素修復機構を抑制し,細胞周期による放射線感受性の差異を低減し,細胞周期を遅らせる効果が強く,組織の隣接細胞の保護効果を低減させる.Bragg ピーク近傍では,分割照射による増強効果が認められる
3.重粒子線の細胞傷害メカニズムはなにか:重粒子線の高RBEの原因はDNA二本鎖の切断で,X線の場合は一本鎖切断が多い.
【解説】著者の Tobias は,粒子線治療の父と称される.ローレンス・バークレイ研究所で初期からサイクロトロンを利用した高LET放射線の生物学,医学応用に関する研究を主導してきたアメリカの物理学者.Tobiasは既に1973年にRadiology誌に,重粒子線の治療応用の可能性について紹介しているが[33],本稿はその後10年にわたって積み上げた放射線生物学的な基礎研究の最終結論とも言える内容で,重粒子線の特性を培養細胞の実験および動物実験の具体的な結果を提示して明らかにし,その後の重粒子線治療の契機となった論文である.線種としてはネオン,シリコンが良いとしており,実際のこの後に続く臨床試験ではネオンが採用された.
出典
- 1. Stone RS, Larkin JG Jr. The treatment of cancer with fast neutrons. Radiology 39:608-20,1942
- 2. Hughes SS. John H. Lawrence, M.D., Nuclear Medicine Pioneer and Director of Donner Laboratory, University of California, Berkeley. Oral History Center, The Bancroft Library, University of California, Berkley (2000)
- 3. Thoday JM, Read J. Effect of oxygen on the frequency of chromosome aberrations produced by X-rays. Nature 160:608,1948
- 4. Thomlinson RH, Gray LH. The histological structure of some human lung cancers and the possible implications fo radiotherapy. Brit J Cancer 9:539-49,1955
- 5. Terashima T, Tolmach LJ. X-ray sensitivity and DNA synthesis in synchronous population of HeLa cells. Science 140:490-2,1963
- 6. Casterall M, Sutherland I, Bewley DR, et al. First results of a randomized clinical trial of fast neutrons compared with X or gamma rays in treatment of advanced tumors of the head and neck. Brit Med J 2(5972):653-6,1975
- 7. 関山重孝, 恒元博, 稲田哲夫 他.人体腫瘍に対する速中性子線の効果特にレ線との比較に於て.癌の臨床 16:1077-83,1970
- 8. Wambersie A. A fast neutron therapy at the end of 1988 - A survey of the clinical data. Strahlenther Onkol 166:52-60,1990
- 9. 宮本忠昭. 速中性子線の臨床. 癌の臨床 41:1685-90,1995
- 10. Slatkin DN. A history of boron neutron capture therapy of bran tumours. Barin 114:1609-29,1991
- 11. Gabel D. Present status and perspectives of boron neutron capture therapy. Radiother Oncol 30:199-205,1994
- 12. Hatanaka H. A revised boron-neutron capture therapy for malignant brain tumors. J Neurol 209:81-94,1975
- 13. Mishima Y, Honda C, Ichihashi M, et al. Treatment of malignant melanoma by single thermal neutron capture therapy with melanoma-seeking 10B-compound. Lancet 2:388-9,1989
- 14. Aihara T, Hiratsuka J, Morita N, et al. First clinical case of boron neutron capture therapy for head and neck malignancies using 18F-BPA PET. Head Neck 28:850-5,2006
- 15.Suzuki M, Kato I, Aihara T, et al. Boron neutron capture therapy outcomes for advanced or recurrent head and neck cancer. J Radiat Res 55:146-53,2014
- 16. Miyatake S, Kawabata S, Yokoyama K, et al. Survival benefit of boron neutron capture therapy fo recurrent malignant gliomas. J. Neurooncol 91:199-206,2009
- 17. http://www.researchgate.net/ (CC BY 4.0)
- 18. Pickles T, Goodman GB, Rheaume DE, et al. Pion radiation for high grade astrocytoma: Results of a randomized study. Int J Radiat Oncol Biol Phys 37:491-7,1997
- 19. Pickles T, Goodman GB, Fryer CJ, et al. Pion conformal radiation of prostate cancer: Results of a randomized study. Int J Radiat Oncol Biol Phys 43:47-55,1998
- 20. Bragg WH, Kleeman R. On the ionization curves of radium. Phil Mag 8:726-38,1904
- 21. Bragg WH, Kleeman R. On the alpha particles of radium and their loss of range in passing through various atoms and molecules. Phil Mag 10:318-40,1905
- 22. Tobias CA, Anger HO, Lawrence JH. Radiological use of high energy deuterons and alpha particles. Am J Roentgenol 67:1-27,1952
- 23. Lawrence JH, Tobias CA, Brom JL, et al. Heavy particle therapy in acromegaly. Acta Radiol 58:337-47,1962
- 24. Suit H. Proton beams in clinical radiation therapy. J Jap Soc Radiol Oncol 3:191-8,1991
- 25. American Society for Radiation Oncology. ASTRO Model policies - Proton beam therapy (PBT)
- 26. Allen AM, Pawlicki T, Dong L, et al. An evidence based review of proton beam therapy: The report of ASTRO’s emerging technology committee. Radiother Oncol 103:8-11,2012
- 27. 医用原子力技術研究振興財団 https://www.antm.or.jp/
- 28. Blakely EA, Ngo FQH, Curtis SB, et al. Heavy-ion radiobiology: Cellular studies. Adv Radiat Biol 11:295-389,1984
- 29. Linstadt DE, Castro JR, Phillips TL. Neon ion radiotherapy. Results of the phase I/II clinical trial. Int J Radiat Oncol Biol Phys 20:761-9,1991
- 30. Malouff TD, Mahajan A, Krishnan S, et al. Carbon ion therapy: A modern review of an emerging technology. Front Oncol 10:,2020
- 31. 山田滋,山本直敬,小藤昌史他.重粒子線治療の現状-重粒子線治療の最新の治療成績と展望.Radioisotopes 68:395-402,2019
- 32. Alonso JR, Castro JR. Light-ion therapy in the US: From the Bevalac to ?? https://www.osti.gov/servlets/purl/803872 (U.S. Department of Energy Office of Scientific and Technical Information. 2002)
- 33. Tobias CA. Pretherapeutic investigations with accelerated heavy ions. Radiology 108:145-58,1973
