- 核医学画像装置
- シンチスキャナ
- ガンマカメラ
- 原著論文
- 1951 シンチスキャナの発明
- 1958 ガンマカメラの発明
- 関連事項
- Benderカメラ
- SPECT・PET
- 原著論文
- 1963 核医学断層法の原理
- 1975 PET
核医学画像装置
シンチスキャナ
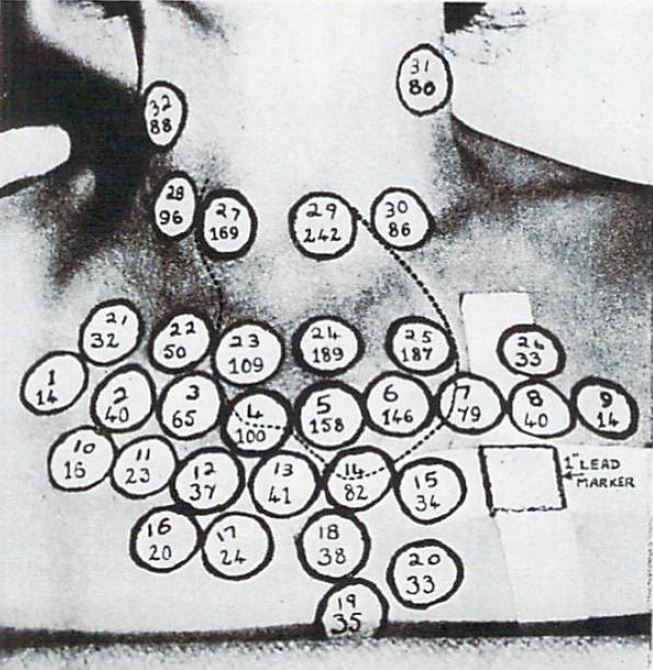
図1. 前頸部の各部位で放射能を手動で計測し,その値から甲状腺腫の輪郭(点線)をもとめている.計測時間は1ヵ所あたり約2分だった[7].

図2. シンチスキャナ(東芝RDA-106型,1966年).検出器(→)が往復移動しながら計測する[8].
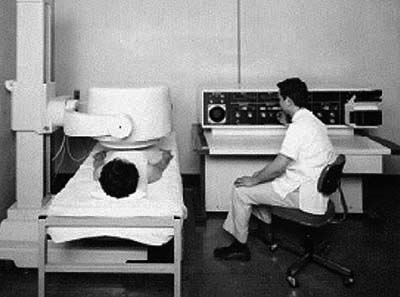
図3. ガンマカメラ(東芝GCA-202型,1971年)[10]
1940年代,Hertzらが放射性ヨウ素による甲状腺機能亢進症の診断,治療を試みて以来[1,2],甲状腺内の放射性物質の分布を知ることが重要となり,前頸部の皮膚面を小区画に分け,それぞれGM管などでカウントして方眼紙に等線量図を描く等反応図(isoresponse chart)が作られるようになった(図1).1951年,アメリカのBen Cassen[→原著論文],イギリスのW. V. Mayneord[3] はそれぞれ独立にこの等反応図を機械的に自動化する方法を開発した.計測器としては,Cassenはタングステン酸カルシウムのシンチレーションカウンタ,MayneordはGM管を使用した.このような検出器を移動して体内の放射能分布を画像化する装置(rectilinear sanner)は,シンチレーションスキャナ(scintillation scannerあるいはシンチスキャナ)と呼ばれるようになった(図2).
Cassenらの方法は,シンチレーションカウンタを電動モーターで機械的に往復移動させながら,インクペンで記録紙に信号を描画する二値画像であったが,1952年,医学生 David E. Kuhl は放電管を利用して光線の輝度に変換しグレイスケール表示することにより通常のX線フィルムに記録できる装置 Photoscan を発明し,以後放射線科医に急速に普及した[4].散乱線対策としては,単孔型コリメータが使用されていたが,1952年にNeweが現在のような多孔焦点型コリメータ(multihole focusing collimator)を開発し[5].さらに1954年にはAllenがγ線のエネルギースペクトルを計測して一定以上のエネルギーを持つγ線のみカウントする波高解析法(pulse height analysis)を導入し,散乱線の影響をさらに低減した[6].
ガンマカメラ
シンチスキャナは広く臨床に供されたが,分解能が低く,検査時間も長時間を要するものであった.これにかわって本格的な核医学画像の第一歩となったのが,カリフォルニア大学の物理学者Angerが開発したシンチレーションカメラ,いわゆるガンマカメラである(図3).
1958年の論文[→原著論文]に記載された装置は,ピンホール式の単開口部から入射するγ線を直径4インチのNaI(Tl)シンチレータで受光,7本の光電子増倍管で検出して,その信号強度分布から電子ロジック回路よって位置情報を求めてオシロスコープに輝点として表示するものであった.シンチスキャナと異なり検出器は固定しており機械的なスキャン動作が不要なので,撮影時間も大幅に短縮されたが,受光部はピンホール式なのでまだ収集効率は低くかった.しかし,さまざまな改良が加えられ,1964年に発表されたもの はシンチレータ径11.5インチ,光電子増倍管19本を備え,多孔焦点型コリメータが採用され[9],さらにこの頃から99mTc製剤が導入されて薄いシンチレータが使用できるようになったこととも相俟って急速に普及した.
現在使われているガンマカメラは基本的に同じ構造で Angerカメラと呼ばれているが,これ以外にもアメリカの放射線科医Merrill A. Benderが開発した Benderカメラも一部で使われた(→関連事項).
原著論文

図4.(上)シンチスキャナ.下面に突出している検出器がモーターにより自動的に移動する.(下)インクペンで紙に記録された甲状腺の画像[7].
【要旨】
タングステン酸カルシウムをシンチレータとして,甲状腺などの組織の境界を検出する局在検出カウンタを製作した.これは光電増倍管を架台に固定し,手動ハンドルでネジを回転することにより直交する2方向に動かせる.これにより甲状腺の輪郭を正確に記録できた.またハンドヘルド局在検出カウンタは,空間分解能ではやや劣るが高感度でずっと簡便に使うことができる.一定の計測値の範囲に線を描くことによって甲状腺の輪郭を推測し,剖検と比較して良い一致が見られたが,煩雑で時間がかかることから,自動スキャナを開発した.これは,局在検出カウンタを架台に載せて減速ギアを介して電気モーターで駆動して1/8インチ間隔で往復移動させるもので,パルスを検出するとインクペンが降りて架台に固定した記録紙に長さ1/8インチの線を描画する.摘出甲状腺での試験を経て,実際の患者でマッピングを行なった.
【解説】
冒頭で紹介されている局所検出カウンタは,手動でハンドルを回してシンチレータを縦横に移動して計測し,手書きで甲状腺の輪郭を描画するものであるが,論文の後半ではこれを自動化した装置について述べられている.これは後にシンチスキャナと呼ばれるようになるもので,放射性ヨウ素の局在決定を目的として設計されたシンチレーションカウンタを架台に載せ,これを電動モーターで機械式に往復させて,カウントをペンレコーダーで記録する方法である(図4).最後に付け足しのように,ヒト甲状腺のシンチグラムが掲載されている(図4).症例に関する詳しい説明はないが,世界初の臨床シンチグラムである.甲状腺の検査には,当初1~1.5時間を要したという.ほどなくシンチカメラ(ガンマカメラ)に取ってかわられたが,核医学画像の誕生という点で歴史的な意義があった.
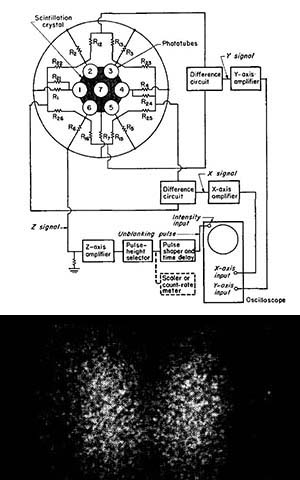
図5.(上)ブロック回路図.7本の光電子増倍管の出力から線源の位置を決定する電子ロジック回路が重要な役割を果たす.(下)甲状腺の臨床画像.
【要旨】
既存の装置に比してはるかに高感度なガンマ線カメラについて述べる.線源は131Iで,ピンホール開口部を備えた鉛遮蔽内に平板NaIシンチレータ(直径4インチ,厚さ1/4インチ)を置き,7本の光電子増倍管(直径1.5インチ)で受光する(図5).光電子増倍管からの電気パルスは電気回路で位置情報(X,Y),強度情報(Z)に分けられ,波高弁別器を介してオシロスコープに表示され,これをポラロイドカメラで撮影する.ヒト甲状腺のin vivo画像を,131I 7.5~12.5μCi,12~15分で撮影した.撮影と同時に131Iの定量も可能である.
【解説】
現在も核医学画像の基本であるガンマカメラの基本構造に関する論文である.これは一般にAngerカメラと言われるように,事実上Angerが単独で発明,開発した装置である.Angerは1952年の初報[11]以来,関連する論文をいくつか著しているが,この論文は装置とその原理,画質を左右する条件を詳述し,それまでの研究の総括的な内容となっている.この中で特に注目すべきは,複数の光電子増倍管の出力分布から線源の位置を決定する電子回路ロジック(いわゆるAnger logic)である.掲載されている甲状腺の臨床画像はまだ十分なものとは言えないが,この後さまざまな改良が加えられ,131Iよりもイメージングに適した99mTc製剤の供給開始も手伝い,1960年代以降急速に普及することとなった.
関連事項
Benderカメラ
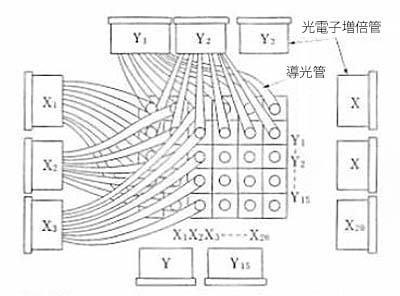

図6. (上)Benderカメラの基本構造.モザイク状に配列したNaI結晶それぞれから行方向,列方向の光電子増倍管に各1本の導光管 がつながっている[13].(下) 導光管[14].
当時,シンチレーションカメラとしてはAngerカメラ以外にもアメリカの放射線科医Merrill A. Bender,放射線物理学者Monte Blauが開発した Autofluoroscope,別名Benderカメラがあった[12].
Angerカメラが検出器として1枚の大きなNaI結晶を使用しているのに対して,直径約1cm,厚さ5cm程度の小さなNaI結晶をモザイク状に約300個ならんでいる.各結晶から2本の透明プラスチック(プレキシガラス)製の導光管(light pipe)が,行方向,列方向各15~20本の光電子増倍管に1つずつつながっており,発光した結晶を同時に検出した光電子増倍管の行列内の位置から局在を知ることができる(図6) .
Angerカメラにくらべて,感度が高いこと,波高解析が不要で光電子増倍管の感度の不均一の影響を受けにくいことなどが利点とされている.Baird-Atomic社から市販され,時間分解能に比較的優れることから,心血管系,腎臓の動態解析などに利用されたが,構造が複雑なためあまり普及しなかった.
SPECT・PET
SPECT
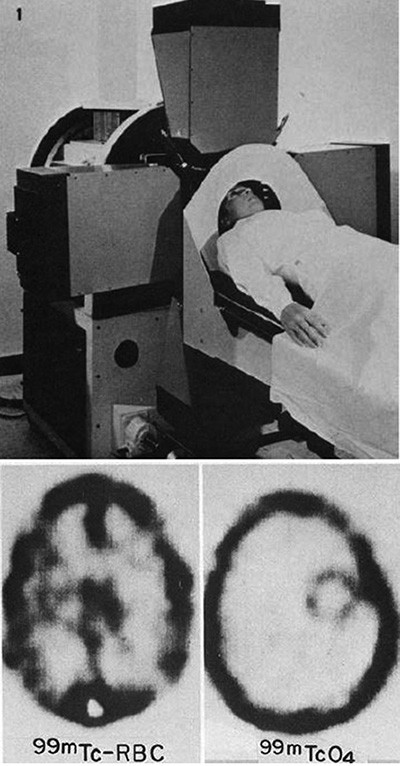
図7. Kuhlらが開発した断層撮影装置Mark IV.その後のSPECTのプロトタイプとなった.[18].
核医学における断層撮影の原理を最初に提唱したのは,Pennsylvania大学のDavid E. Kuhlで,1958年にファントム実験であるが回転スキャンによる断層像の可能性を実証している[15].1963年に技術者のRoy Q. Edwardsと協力し,従来のX線断層撮影の原理が核医学画像にも応用して,軸位断を含め任意の断層面を再構成できることを理論的に示した[→原著論文].
その後,Kuhl,Edwardsらは後のリング型SPECTのプロトタイプとなる装置* Mark II(1964)[16], Mark III (1970)[17],Mark IV(1976)[18](図7)を次々と開発,断層像の臨床的有用性を示した.これは,軸位断層像の撮影という意味では,1973年のGodfrey HounsfieldによるX線CTに先立つものであった.またMark III機によるヒト脳血流の成功は,その後のPETによる脳代謝検査の先駆であった[19].
1977年,アメリカのRonald J. Jaszczakら,John W. Keyesらがほぼ同時に,シンチレーションカメラを利用したSPECT装置を発表し[20,21],これが現在広く使用されているガンマカメラ型SPECT装置のプロトタイプとなった**.
* Kuhlらはこれらの装置を単に radioisotope scanner と称している.その後1977年に Emission computed tomography (ECT)という用語を初めて使用しており[23],1978年にKeyesがSingle photon ECT[24],1979年にJaszczakがSPECTと表記し[25],以後SPECTが広く使用されるようになった.
**1965年に,Angerもシンチレーションカメラによる断層撮影に成功しているが,これは軸位断ではなく,通常のX線断層法のようにカメラを平行移動することにより,深さ方向に等間隔,12枚の断層像を得ている[22].
PET
1928年,イギリスの物理学者Paul Diracは陽電子(positron)の存在を予測し,1932年にアメリカの物理学者Carl Anderson がこれを実験的に証明した.さらにドイツのHans Betheは,陽電子と陰電子が衝突して消滅する陽電子消滅現象を発見,Joliot-Curieは陽電子発生核種30Pの合成に成功した.

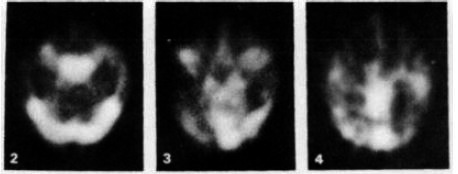
図8.Ter-Pogossianが設計したPETT III.(1976年 ).現在のPETの原型となった.下段:11CO-カルボキシルヘモグロビンによるヒト脳の横断像.[32].
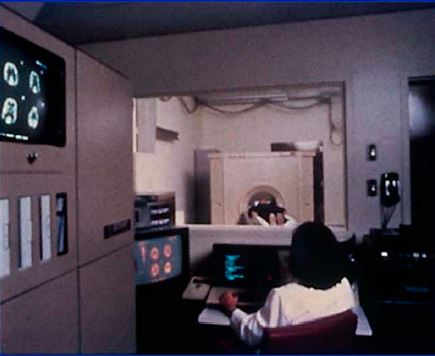
図9. 初の商用PET装置ECAT I (1979年)[39].
陽電子を医用画像に初めて応用したのは,1951年,アメリカのマサチューセッツ総合病院(MGH)の脳神経外科部門で,物理学者Gordon L. Brownellらが,脳シンチグラムのノイズ低減を目的として試みられたものであった[26,27].1953年には,脳腫瘍の診断における臨床的有用性が報告された[28].これは,頭の両側に置いたNaI検出器を平行移動するもので,核種は74Asを使用した.Brownellらはその後も様々な改良を加え,1972年に発表されたPC-Iでは,2次元配列された検出器を平行運動,回転運動させ,逆投影法により初の断層像が得られた[29,30].その後PC-IIが開発されMGHで臨床例が蓄積された.
1975年,Washington大学のMichael Ter-Pogossianが,Kuhlの方法とBrownellの装置を組合わせ,六角形の各辺に4個の検出器を計24個配置したフレームを回転させるPETT (Positron Emission Tranaxial Tomography)*を開発し(図13)[→原著論文],翌年には検出器48個のPETT IIIで臨床例の撮影に成功,現在のリング型装置のプロトタイプとなった(図83)[32].その後 Ter-Pogossianらは,Pennsylvania大学のKuhlらと共同してPETTをもとに1979年に初の商用機ECAT I,その後ECAT IIを開発し(図9),これらはカリフォルニア大学(UCLA)に設置されてその有用性が広く認識された[34].これと平行して,Brownellらも,1980年代に固定検出器をリング状に配列したPCR-I,PCR-IIを開発した[33].
* Ter-pogossianらは,1978年まではPositron Emission Transaxial Tomography (PETT)と称しているが,1979年以降は Positron Emission Tomography (PET)と記載している.1978年には,第1回 International Symposium on Positron Emission Tomography がカナダで開催されており,この頃からPETの略称が定着したものと思われる.
PETに使用される陽電子放出核種は,当初は15O2, 15CO, 15CO2による脳血流検査が主流であったが,1970年代になるとサイクロトロンの医用利用が進み,11C, 13N, 18Fなどが利用できるようになった.1978年,Louis Sokoloff(米国精神衛生研究所),Alfred Wolf (ブルックヘヴン国立研究所)らが,カリフォルニア大学のKuhlらとともに脳代謝の測定を目的として開発した18FDG [34,35]は,その後腫瘍診断に利用されてPETの適応拡大,普及に大きな役割を果たし,現在に至るまで臨床的に最も頻用される核種となっている.
PET-CT
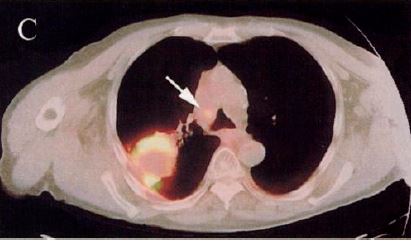
図10. PET-CT(2000年).肺癌とその縦隔転移(→)[40].
核医学画像の欠点のひとつに,解剖学的な局在情報の取得が難しいことが挙げられる.早くも1966年に,Kuhlらはtranmission scanと emission scanを同時に撮影する方法を提唱しているが,実用にはいたらなかった[36].この問題を根本的に解決したのが Geneva大学のDavid Townsend,Tennessee大学のRonald Nuttが1990年代に開発した,PETとCTを1台の装置に組込んで患者を移動することなく連続して撮影,画像を合成するPET-CTであった[37](図10).1998年にPittsburgh大学でプロトタイプが稼働し,特にFDGによる腫瘍診断における有用性が高く評価され,2001年にGE社(Discovery LS),次いでSiemens社(Biograph)により製品化された*.PET-CTは以後急速に普及し,2006年には単独PET装置は姿を消した[35].
*これに先立つこと10年以上前の1984年,群馬大学の永井輝夫らと日立製作所は,PETとCTを横並びに並置し,電動寝台で患者を移動して撮影,両者の画像を合成する装置を開発していた.PET-CTの先駆と言えるものであったが試作に終わった[38].Townsendらはその存在を知らなかったと述べている[39].
原著論文
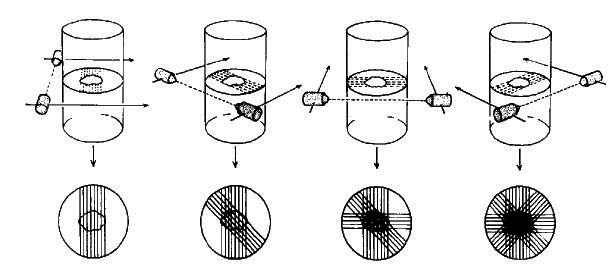
図11. 横断層スキャンの原理.核医学でも断層像画可能であることを理論的に示し,現在のSPECT,PETへの道を拓いた.
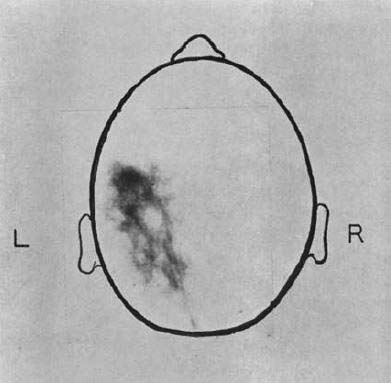
図12. 本稿の翌年に発表された臨床像.197Hg-chlormerodrinによる左頭頂葉腫瘍の断層像[41].
【要旨・解説】
X線断層撮影は既に1930年代から行われていたが,この核医学画像への応用可能性について理論的に検討し,ファントム実験で実証したもので,現在のSPECT, PETの原点となる論文である.
従来のシンチスキャンである直線スキャン(rectilinear scannnig)を対照とし,ステレオ撮影の原理を流用する立体スキャン(stereoscopic scanning),X線断層の原理による断層スキャン(section scanning)について検討し,さらに断層スキャンについては前額断を得る縦断層スキャンと,軸位断を得る横断層スキャンを検討した(図11).
立体スキャンは,管球を傾けて視差を利用したステレオ像を作り,ステレオスコープで観察することにより奥行き情報を得る方法であるが,上下層の分離が不充分であった.断層スキャンは,X線断層法を拡張してX線管球と検出器を,焦点を挟んで移動する方法で,縦断層スキャンと横断層スキャンともに,異なる深度にある被写体を充分に分離できた.ここでは臨床例は供覧されていないが,翌年には脳,肝の臨床像を報告している[41](図12).
横断層スキャンは,その後のSPECT,PETに連なる方法であるが,ここではオシロスコープ上の輝線をフィルムで記録するアナログ的な処理にとどまっている.Kuhlはその後もこの方法の改良を続け,1968年にはパンチテープを利用したデジタル処理による方法を発表している[42].これは1979年に初の商用機となったECAT Iの原型である.
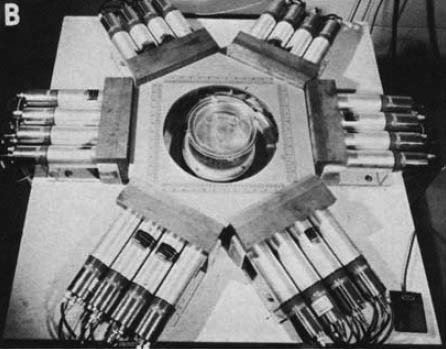
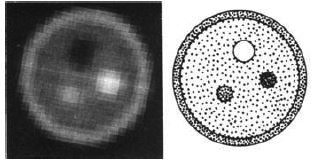
図13 .上段:プロトタイプPETTの外見. 六角形の各辺に4本のNaI検出器が配置されている.中央の回転台の上にファントムが置かれている.下段:ファントムの軸位横断像.
【要旨】陽電子の消滅放射線を利用した画像はこれ以前にも発表されていたが,現在のように検出器をリング状に配列し,軸位断層像を撮影するPETの原型を試作した初の論文である.著者のTer-PogossianはPETの父と呼ばれることがある.
新しい装置,PETTは,NaI検出器を六角形に24個配列したもので(図13),被写体を載せた回転台を7.5°ずつ360°回転し,同時検出回路から得られたデータをミニコンピュータ処理して軸位横断画像を再構成する.再構成アルゴリズムはフーリエ法を使用し,計算時間は約25秒である.消滅放射線同時検出法は,従来のシンチレーションカメラによる単光子検出法と比較して,コリメータが不要であることから,コントラスト,解像度に優れ,深度依存性もないことから,明瞭な画像が得られる.このことをまずファントム実験で証明し,ついでイヌを使った動物実験で実際の画像を供覧した.陽電子放出核種としては,H215O, 13NH3, 11CO,18Fを使用し,胸部の血液プール,軟部組織などの軸位断層像の撮影に成功した.
PETTは,陽電子放出核種しか使用できないという制約があるが,形態のみならず機能の可視化につながる多くの有望な核種があり,核医学に新しい領域を拓くものである.
【解説】ファントムおよび動物実験用であるが,PETの原型といえる装置である.これ自体は決してTer-Pogossian独自のものではなく,冒頭で述べられているようにKuhlが考案した断層法の原理,Brownellらの装置をもとに開発されたのが,その後のPET開発の原点となった.本稿の最後に,現在検出器を48個備えた装置を開発中との記載があるが,実際この翌年に発表されたPETT IIIは現在のPETと同様の外観で,正常ボランティア,患者の脳,心臓の断層画像を提示している(図83)[32].
出典
- 1. Hertz S, Roberts A. Radioactive iodine as an indicator in thyroid physiology. IV. The metabolism of iodine in Graves' disease. J Clin Invest 21:25-29,1942
- 2. Hertz S, Roberts A. Radioactive iodine as an indicator in thyroid physiology. VII. The use of radioactive iodine theapy in hyperthyroidism. JAMA 131:81-6,1946
- 3. Mayneord WV, Turner RC, Newbery SP, Hodt HJ. A method of making visible the distribution of activity in a source of ionizing radiation. Nature 168:762-5,1951
- 4. Kuhl DE, Chamberlain RH, Hale J, et al. A high contrast photographic recorder for scintillation counter scanning. Radiology 66:730-9,1956
- 5. Newell R, Saunders W, Miller E. Multichannel collimators for gamma scanning with scintillation counters. Nucleonics 10:36,1952
- 6. Allen HC, Reiser JR, Green JA. Improvements in outlining of thyroid and localization of brain tumors by the application of sodium iodide gamma-ray spectrometry techniques. Proceedings of the Second Oxford Radioisotope Conference. Vol. 1:76-96, New York, Academic Press, 1954
- 7. Ansell G. Radioactive iodine as a diagnostic aid for intrathoracic goitre. Brit J Radiol 21:552-8,1948
- 8. 日本画像医療システム工業会.医用画像電子博物館(http://www.jira-net.or.jp/vm/data/1966000001/1966000001_all.html)
- 9. Anger HO. Scintillation camera with multichannel collimators. J Nucl Med 5:515-31,1964
- 10. 日本画像医療システム工業会.医用画像電子博物館(http://www.jira-net.or.jp/vm/data/1971000004/1971000004_all.html)
- 11. Anger HO. Use of a gamma-ray pinhole camera for in vivo studies. Nature 170:200-1,1952
- 12. Bender MA, Blau M. The autofluoroscope. Nucleonics 21:52-56,1963
- 13. 久田欽一著.最新核医学(全訂第6版)(金原出版,1967)
- 14. Husain SS. Pioneering nuclear medicine in Buffalo, NY. J Nucl Med 45:30N-35N,2004
- 15. Kuhl De. Rotational scanning of the liver. Radiology 71:875-6,1958
- 16. Kuhl DE, Edwards RA. Cylindrical and selection radioisotope scanning of the liver and brain. Radiology 83:926-36,1964
- 17. Kuhl DE. The Mark III scanner: A compact device for multiple-view and section scanning of the brain. Radiology 96:563-70,1970
- 18. Kuhl DE, Edwards RA, Ricci AR, et al. The Mark IV system for radionuclide computed tomography of the brain. Radiology 121:405-13,1976
- 19. Kuhl DE, Reivich M, Alavi A, et al. Local cerebral blood volume determined by three-dimensional reconstruction of radionuclide scan data. Circulat Res 36,610-9,1975
- 20. Jaszczak RJ, Murphy PH, Huard D, et al. Radionuclide emission computed tomography of the head with 99mTc and a scintillation camera. J Nucl Med 18:373-80,1977
- 21. Keyes Jr JW, Orlandeo N, Heetderks WJ, et al. The Humongotron - A scintillation-camera transaxlal tomograph. J Nucl Med 18:381-7,1977
- 22. Anger HO. Multiplane tomographic gamma-ray scanner. Medical Radioisotope Scintigraphy. Proceedings of a symposium, Salzburg, 6-15 August 1968, 1:203-16,1968
- 23. Kuhl DE, Phelps ME, Hoffman EJ, et al. Initial clinical experience with 18F-2-fluoro-2-deoxy-d-glucose for determination of local cerebral glucose utilization by emission computed tomography. Acta Neurol Scand Suppl 64:192-3,1977
- 24. Keyes JW, Leonard PF, Bdody SL, et al. Myocardial infarct quantification in the dog by single photon emission computed tomography. Circulation 58:227-32,1978
- 25. Jaszczak RJ. Whole-body single-photon emission computed tomography using dual, large-field-of-view scintillation cameras. Phys Med Biol 24:1123-43,1979
- 26. Sweet WH. The use of nuclear disintegration in the diagnosis and treatment of brain tumor. New Eng J Med 245:875-8,1951
- 27. Wrenn Jr. FR, Good ML, Handler P. The use of positron emitting radioisotopes for localization of brain tumors. Science 113:525-5,1951
- 28. Brownell GL, Sweet WH. Localization of brain tumors with positron emitters. Nucleonics. 1140-5,1953
- 29. Burnham CA, Brownell GL. A multi-crystal positron camera. IEEE Transactions on Nuclear Science NS-19:201-5,1972
- 30. Brownell GL, Burnham CA. MGH positron camera. NEREM 1972 Record. 2:117,1972
- 32. Hoffman, EJ, Phelps ME, Mullani NA, Higgins CS, Ter-Pegossian MM. Design and performance characteristics of a whole-body positron transaxial tomography. J Nucl Med 17:493-502,1976
- 33. Brownell GL, Burnham CA, Stears CW, et al. Development in high resolution positron emission tomography at MGH. International Journal of Imaging Systems and Technology. 1:207-17,1989
- 34. Phelps ME, Hoffman EJ, Kuhl DE. Tomographic measurements of local cerebral metabolic rate in humans with (F-18) 2-fluoro-2-deoxy-D-glucose:validation of methods. Ann Neurol. 6:371-88,1979
- 35. Fowler JS, Ido T. Initial and subsequent approach for the synthesis of 18FDG. Seminar Nucl Med 32:6-12,2002
- 36. Kuhl DE, Hale J, Eaton W. Tranmission scanning: A useful adjunct to conventional emission scanning for accurately keying isotope deposition to radiographic anatomy. Radiology 87:278-84,1966
- 37. Townsend DW. Combined positron emission tomography–computed tomography: The historical perspective. Semin Ultrasound CT MRI. 29:232-5,2008
- 38.対馬義人. 世界初の群馬大学・日立の並列型PET/CT装置. メディックス. 64:8-13,2016
- 39. Jones T, Townsend D. History and future technical innovation in positron emission tomography. J Med Imag 4:1-17,2017
- 40. Beyer T, Townsend DW, Brun T, et al. A combined PET/CT scanner for clinical oncology. J Nucle Med 41369-79,2000
- 41. Kuhl DE, Edwards RQ. Cylindrical and section radioisotope scanning of the liver and brain. Radiology 83:926-36,1964
- 42. Kuhl DE, Edwards RQ. Reorganizing data from transverse section scans of the brain using digital processing. Radiology 91:975-83,1968
