- MRI
- NMR(核磁気共鳴現象)
- MRI(NMRの画像化)
- 原著論文
- 1971 NMRの臨床的有用性
- 1974 NMRの画像化
- 1977 初の人体のMRI画像
- 1980 スピンワープ法
- 関連文献
- 1985 Lauterburによる10年間のMRI研究の回顧
- 関連事項
- DamadianとFONAR社
- 臨床用MRI装置の開発
- 原著論文
- 1982 0.35T装置
- 1984 1.5T装置
- 関連事項
- "Field war"
- MR 血管撮影(MRA)
- 原著論文
- 1986 位相コントラスト法MRA
- 1988 Time-of-flight法MRA
- ガドリニウム造影剤
- 原著論文
- 1984 Gd-DTPA
MRI

図1.Felix Bloch(左), Edward Purcell(右).1946年,それぞれ独立に核磁気共鳴現象を発見,1952年にノーベル物理学賞を受賞[PD].
NMR(核磁気共鳴現象)
磁気共鳴現象(NMR, nuclear magnetic resonance)は,磁場の中で物質に,その磁場強度によって決まる特定の周波数の電磁波を照射すると,物質中の分子のエネルギー状態が変化する物理現象である.これは,1946年,スタンフォード大学のFelix Bloch,ハーバード大学のEdward Purcellが(図1),それぞれ独立に,ほぼ同時に発見したもので[1,2],1952年のノーベル物理学賞はこの両者に授与された.初期には,分子中の化学結合によって共鳴周波数がずれる化学シフト現象(chemical shift)が研究され,分析化学の強力なツール,MRスペクトロスコピーへと発展した.
生体試料計測の応用として最初に行なわれたのは組織の緩和時間の測定で,例えばスウェーデンKarolinka大学のOdebladらは1954年以降十数年にわたって血清,乳汁,筋肉など様々な組織の緩和時間を60編以上の論文に報告している[3].生体組織のスペクトル分析は,1973年,Moonらによる赤血球の31Pスペクトル測定が初報とされる[4].しかし当時のマグネットのボア径はせいぜい5cm程度であったため標本試料の計測にとどまり,動物実験は難しかった.
MRI (NMRの画像化)

図2.MRIの発明に貢献した研究者.(左) Raymond Damadian, (中) Paul Lauterbur, (右) Peter Mansfield.
NMRの医学応用の端緒となったのは,1971年,米国ニューヨーク州立大学の内科医Raymond Damadian(図2)が,ラットの腫瘍の切除標本の緩和時間が正常組織と異なることを報告し,緩和時間による腫瘍診断の可能性を示唆したことに始まる[→原著論文].翌1972年,Damadianは全身計測装置の特許を申請しているが[5],これは全身をコイルの中にいれて緩和時間を計測するもので,画像化するものではなかった.
1971年,同じニューヨーク州立大学の化学者Paul Lauterbur(図2)は,大学院生がDamadiaのラットの実験を追試しているのを目にし,摘出標本ではなく生体そのものを画像化する方法を考え,1973年にこれを発表した[→原著論文].これは傾斜磁場を使用して1次元位置情報を得て,逆投影法により2次元画像を再構成する方法で,その後のMRIの基本となる画期的な論文であった.Lauterburはこの方法を zeugmatography*と呼んだ.
* Zeugma は「軛(くびき)」を意味するギリシア語で,化学情報と位置情報を結びつける,という意味で命名された.しかしこの言葉は普及せず,主にNMR imagingと呼ばれたが,nuclearが放射線を扱う核医学(nuclear medicine)を連想させるなどの理由でMRI(magnetic resonance imaging, 磁気共鳴画像法)が一般的となった[6] .
Lauterburにやや遅れて,イギリスで複数の研究グループが画像化の道を探り,1976年,Notthingam大学のPeter Mansfield(図2)は,選択励起法を開発し,1977年にヒトの指[→原著論文],1978年に腹部[7]の画像を発表した.Mansfieldの方法も傾斜磁場を利用する点ではLauterburと同じであるが,当時MansfieldはLauterburの論文を知らず,独自に考案したものであった.現在使われているFourier変換法MRIは,1975年にスイスのKumar,Ernstらが Fourier zeugmatographyとして提案し[8],1980年にAberdeen大学のEdelsteinがこれらの技術を組合わせてスピンワープ法を発表して,その後現在に至るMRI撮像法の基礎が完成した[→原著論文].
NMRの臨床応用の火付け役となったDamadianは,独自の路線を歩み,焦点磁場法による全身用MRIを世界に先駆けて試作し,世界初の臨床機を提供したが不成功におわった(→関連事項).
原著論文
《1971-NMRの臨床的有用性》
図3.この論文の翌年,Damadianが申請した特許[5]
【要旨】5匹の正常ラット,Walker肉腫を植えたラット5匹,Novikoff肝癌を植えたラット3匹の切除組織のT1値,T2値を測定した.この他,2例の良性腫瘍(線維腺腫)のT1値も測定した.測定装置は,Varian社製,5,610ガウスのスペクトロメーターである.Walker肉腫,Novikoff肝癌のT1値はそれぞれ0.736秒,0.826秒で,正常肝のT1値は0.293秒で,明らかに異なっていた.T2値もそれぞれ0.100秒,0.118秒で,正常肝は0.052秒であった.悪性腫瘍の細胞内液は,正常細胞にくらべて構造化に乏しいことが報告されており,これが緩和時間の延長の原因と思われる.この結果から,NMRは悪性腫瘍の検出,腫瘍の良悪性の鑑別に有用と考えられる.
【解説】ラットの悪性腫瘍と正常組織のT1値,T2値が異なることから,NMRによる腫瘍の検出,良悪性の鑑別の可能性を提示している.NMRの医学応用の端緒とされる論文であるが,対象はわずか数匹のラットで統計学的な扱いも甘く,論文としての構成はかなり弱い.しかし,この論文の追試をしている学生の実験を目にしたLauterburが,それをきっかけにNMR画像化の理論を発明したという点で,今日のMRIが生まれるきっかけとなったことは確かである.
著者のDamadian自身は,画像化については少なくともこの時点では画像化のことは念頭においておらず,この論文発表の翌年に申請した特許[5]も,人体をコイルの中にいれてNMR信号を測定するというきわめて漠然としたアイデアであり,実動するようなものではなかった(図3).
《1974-NMRの画像化》
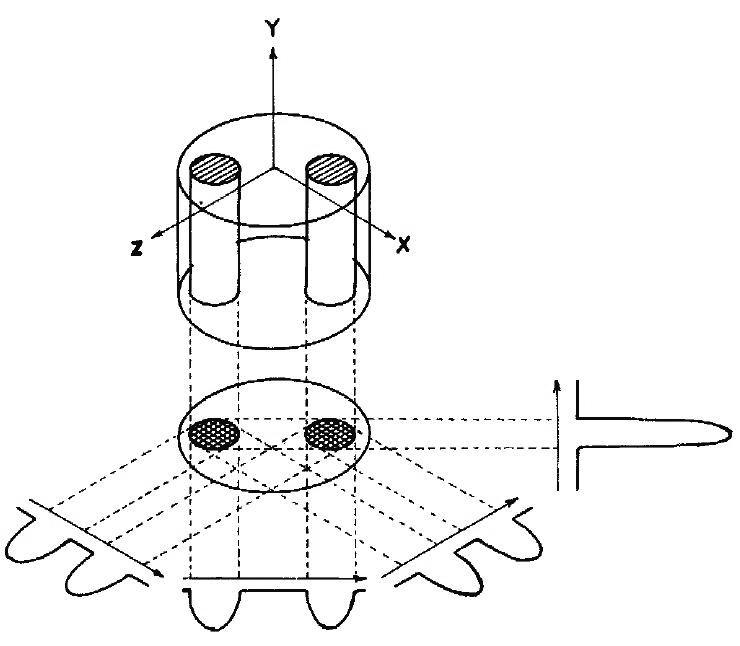
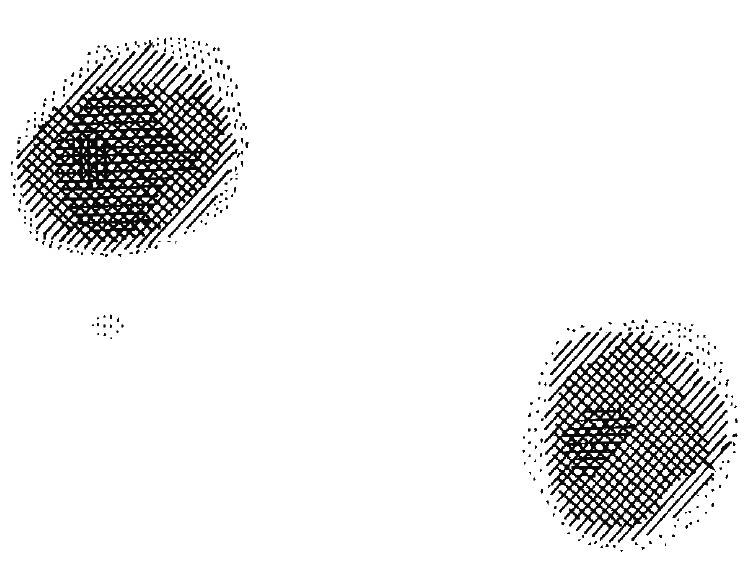
図4.(上)被写体は水を入れた2本のガラス毛細管.勾配磁場をかけて断面の1次元プロファイルを求める.これを複数の方向から繰り返し,逆投影法で2次元画像を再構成する.(下)ガラス毛細管断面像.世界初のNMR画像(MRI).
【要旨】静磁場(60MHz)と勾配磁場(700Hz/cm)を用いて,水を入れた内径1mmのガラス毛細管の1次元投影が得られる.被写体あるいは勾配磁場を回転することによって何回か測定を繰り返し,既知の再構成法(ここでは逆投影法)を用いれば,2次元的な投影が得られる(図4).この方法をズーグマトグラフィ(zeugmatography)と呼ぶことを提案する.
もうひとつの実験では,ガラス毛細管の1本に水,もう1本に硫酸マンガンの溶液を入れて,RF波の出力を大きくすると,T1値の短い硫酸マンガンの画像は減弱する.この事から,異なるT1値を持つ生体の組織を選択的に描出できることが考えられ,悪性腫瘍のin vivo検査への応用が考えられる.
ズーグマトグラフィはこの他にも固体NMRズーグマトグラフィ,電子スピン共鳴ズーグマトグラフィなども可能である.
【解説】タイトルの「誘導局所相互作用」 (induced local interaction)は分かりにくい言葉であるが,位置(局所)に依存する相互作用(この場合は静磁場と勾配磁場)によって取り出すことができる(誘導される)情報による画像法,といった意味で,その一例としてNMRを挙げるという論旨である.具体的には,2本のガラス管の断面像の2次元断面像を求め,その信号強度を濃淡で表示している.再構成法については具体的な記述はないが,CTと同じ逆投影法である.またRF出力を変えることによってT1値の差を描出し,医学応用への可能性を示唆している.
勾配磁場の概念はNMRの時代から存在したが,これを用いて2次元画像を作製,提示したという点で画期的であり,まさにNMRの画像化,すなわちMRIの誕生を意味する論文である.ただし,計測は連続波を使用し,画像再構成法はCTと同じ逆投影法で,その後MRIの基本となるパルス波計測,フーリエ変換法,スピンワープ法などの技術が整ってMRIが実用化されるにはなお10年以上を要することになる.
この論文には,ガラス毛細管ファントムの画像しか掲載されていないが,翌年の論文には木の枝,ナッツ,アサリ,生きたマウスの画像が掲載されている[9].
Lauterburは,腫瘍と正常組織の緩和時間による診断を提案したDamadianの実験にヒントを得てこの方法を考案したものであるが,この点に関しては別の文献[10]を引用している.理由は不明だが,後にDamadianの論文について「コントロールが不十分で喧伝的」[11]と評しており信憑性に疑問をもっていた節がある.
《1977-初の人体のMRI画像》
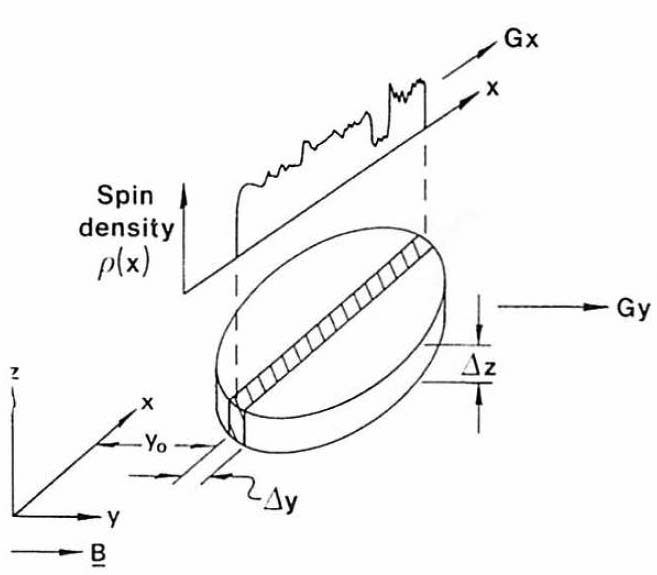
図5. 勾配磁場と選択的照射によるラインスキャン法.勾配磁場で選択した狭い領域の信号プロファイルをフーリエ変換して2次元画像を求める.

図6. 共著者のMaudsleyの第3指中節骨の断面像.中央の白い部分が骨髄,上下の黒い三日月状の部分が伸筋腱,屈筋腱.
【要旨】勾配磁場と選択的照射を組合わせることにより,被写体の一部のみのNMR信号を得る方法を考案した(図5).静磁場にy軸方向の線形勾配磁場Gyを加え,狭い周波数帯域に成型したRFパルスを加えることにより,薄い領域を選択的に励起できる.その後,勾配磁場Gyをオフに,x軸方向の勾配磁場Gxをオンにすることにより,x軸方向のFIDが得られ,フーリエ変換することによりx軸方向のスピン密度分布が得られる.これをオシロスコープの入力とすれば,断面を輝度表示できる.z軸方向の選択についても同様の勾配磁場による選択が可能であるが,ここではコイル感度による幾何学的選択に任せている(厚さ約8mm).
撮像装置は,静磁場15MHz(0.35T),勾配磁場はGx=0.69 G/cm,Gy=0.86 G/cm.この方法でまず鉱油と水のファントムを撮像した.コントラストは,スピン密度よりもT1緩和時定数に依存して決まると考えられた.次に,ヒトの指を撮像した.遅延時間(=TR)0.5秒,64×64マトリックス,加算回数48回,撮像時間23分.指骨,腱などが明瞭に描出できた(図6).さらにガラス管に,ラットの正常組織(皮膚,肝),腫瘍組織(肝癌,肉腫)を入れたものを撮像し,遅延時間を変化させると組織により輝度の差が見られることがわかり,今後の医学への応用が期待できる.
【解説】勾配磁場によって薄い断面を選択励起し,これをフーリエ変換して2次元画像を得る方法で,現在でも用いられることがあるいわゆるラインスキャン法である.勾配磁場を利用する点では,1974年のLauterburの論文と同じであるが,Mansfieldはこれを知らずに独立に考案した.画像再構成法は,Lauterburは逆投影法であったが,ここではフーリエ変換法が使われている.
指の画像は,Mansfieldの学生でもあった共著者Maudsleyの第3指中節骨部で,世界初の生きたヒトのMRI画像となった.本文中に述べられているように,この実験装置はボアが小さく,計測可能な最大径は2cmとのことで,指はぎりぎり撮影可能な被写体であった.きわめて粗いT1強調画像であるが,骨髄が白く,伸筋腱,屈筋腱が黒くうつっている.動脈,神経も見えていると述べているが,これはおそらくノイズであろう.Mansfieldは,ラインスキャン法自体については既に1973年,1975年に報告しており[12,13],1975年の論文では共著者の指の信号強度プロファイルが掲載されているが,2次元画像については本稿が初報である.Lauterburの論文とともに,NMR画像化の重要な契機となった研究であった.
《1980-スピンワープ法》
whole-body imaging
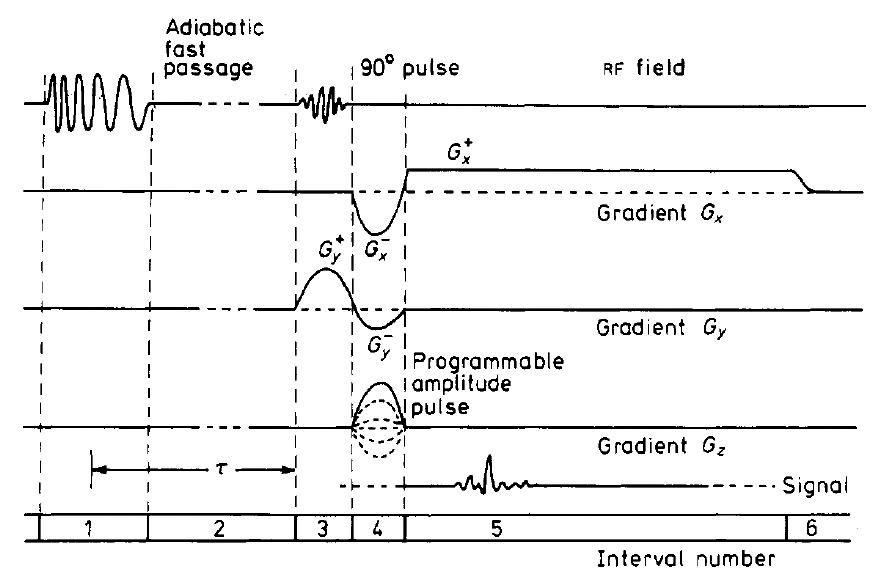
図7. スピンワープ法のパルス系列.その後,ほとんどすべてのパルス系列の基本構造となった.
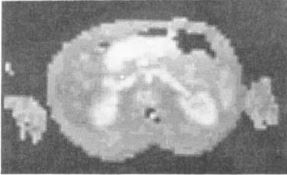
図8. スピンワープ法による腹部横断像.プロトン密度画像.
【要旨・解説】現在のMRI技術の基本となっているspin warp法を初めて示した論文である.NMRを初めて画像化したLauterburの画像再構成法は,CTと同じような逆投影法であった.現在のようなFourier法を提案したのは1975年のKumar & Ernstの論文であるが[8],これに1976年にMansfieldが提案した選択励起法(line-scan法)[→原著論文]を組合わせたものが,このspin warp法である.ここに示されているパルス系列は,MRI入門書の冒頭で必ず目にする図である.
後半には,0.04T(1.7MHz)のスキャナで実際に著者Edelstein自身の頭部,胸部,腹部,大腿を撮影した画像が供覧されている.ヒト体部の画像については,1977年にDamadianが焦点磁場法による初の体部画像を[19],1978年にはMansfieldもline-scan法による自らの腹部の画像を発表しているが[14],いずれも大きな臓器の輪郭がかろうじて見える程度で臨床的には役立つものではなかった.本稿に示されたspin warp法の画像は,低空間分解能(64×64)とはいえ,それなりにコントラストがあり,主な臓器が一通り識別できる点で,その後の臨床応用への可能性を確信させるに十分な画質といえよう(図8).
関連文献
《1985-Lauterburによる10年間のMRI研究の回顧》
図9. 1971~2年にLauterburが未来のNMRイメージングシステムを描いたスケッチ.その後のMRIを正確に予想している.
【要旨・解説】1974年にNMR画像化の端緒を切ったPaul Lauterburが,1985年にジェネラルモーター社の癌研究基金賞を受賞した際の講演記録で,過去10余年にわたる研究の軌跡を振り返っている.タイトルに「癌の検出」とあるが,これは癌研究基金に絡む講演であったためと思われ,その内容は腫瘍の診断だけでなくNMR画像化研究全般におよんでおり,傾斜磁場による画像化の発明を思いついた経緯などが語られている点で興味深い.
1971年にDamadianの論文を追試しているSaryanの実験を目にして,腫瘍診断法としての有用性はともかく,動物の正常組織の緩和時間にも差があることから,そのマップを表示する方法はないかと思いつき,その日の夜にアイデアがまとまったと語っている.画像再構成法は,基本的にCTを発明したHounsfieldの方法と同じであるが,その業績を知ったのは後になってからであり,独立したものであったとも述べている.
1971年の時点で構想したNMRイメージングシステムのスケッチが紹介されており(図9),これはまさに現在のMRI装置である.後にノーベル賞問題で優先権を主張したDamadianは1972年に全身計測装置の特許を申請しているが,画像化は念頭においていないことから,イメージング装置としての構想はLauterburが先んじていたと言えよう.
1976年にはマウスの腫瘍のマップを提示し,1980年代には0.094T装置でヒトの撮像にも成功している.ただし再構成された画像はいずれもT1マップである点では,その後の臨床MRIの方向とは異なっている.
関連事項
DamadianとFONAR社

図10.DamadianがThe New York Times紙に掲載した反論意見広告.「恥ずべき誤りを正す」と題して,自らの業績を挙げてノーベル賞受賞者に選ばれないことは誤りであると論じている.ノーベル賞委員会に再考を促すよう,下端の部分に署名して郵送するように読者に求めている.
緩和時間による腫瘍診断の可能性を提示してNMR臨床応用への道を拓いたアメリカのRaymond Damadian(図2)は,独自の路線を歩んだ.独自の磁場焦点法(field focusing)による装置を開発し,早くも1977年に世界初の全身用撮影装置を完成して体部画像を発表したが,1枚の撮影に4時間45分を要し,画質も実用に耐えるものではなかった(図11).磁場焦点法は,北海道大学の阿部善右衛門らが提案し,非線形傾斜磁場を使って目的とする部位を選択的に励起する方法で,緩和時間の測定やスペクトロスコピーに用いられるが,広い範囲を画像化するには時間がかかり不向きであった[15].
1978年にはFONAR社 (field FOcusing Nuclear mAgetic Resonance)を設立し,1980年に発表した永久磁石を使用したQED80*は世界初の商用機となった(図12).Damadianの関心は,当初の研究以来,一貫して組織の緩和時定数の測定にあり,フーリエ変換法による撮像モードと焦点磁場法による緩和測定モードを備えた独自の仕様であったが,撮像モードで得られる画像は,その後他社が発表した装置に及ばなかった.
*QED80の改良版,QED80 alphaは,1982年に岐阜県の中津川市民病院に,日本初のMRI装置として導入され話題を呼んだが,静磁場強度0.043T(永久磁石),パルス系列はSSFPのみで,画像1枚の撮影に6~8分を要し,臨床的有用性を発揮できないままに終わった[16,17].1987年に発表されたQED Beta-3000は,静磁場強度0.3T(永久磁石)で,ようやく臨床使用に耐える画像が得られたが[18],既に主力メーカーが高性能機を発売しており少数の施設に納入されるにとどまった.
FONAR社はほどなく主力MRIの製造からは撤退したが,同社はmulti-angle oblique法の特許を早くから取得しており,その使用権を巡って主要MRIメーカーと争った.GEを除く各社は早々に示談に応じ,最後まで法廷で争ったGEも1996年に敗訴して1億2千万ドルの罰金を支払うに至った.FONAR社は,特許料から得られる資金をもとに,その後も車載型モバイルMRI,外科用MRI,その他の生体計測装置などニッチ的な製品の開発を続け,現在も立位型MRIなどを提供している.
2003年,LauterburとMansfieldがMRIの発明に対してノーベル生理学・医学賞を受賞した際,Damadianは自分が選に漏れたことに立腹し,The New York Timesなどいくつかの新聞に大々的な反論広告を掲載して見直しを要求したが(図10),もちろんこれが覆ることはなかった.DamadianがMRIの発明者としてノーベル賞に相応しいかという点については意見の分かれるところで,NMRの医学応用の可能性を示したことは確かであるが,画像化への寄与は乏しかったと言えよう.
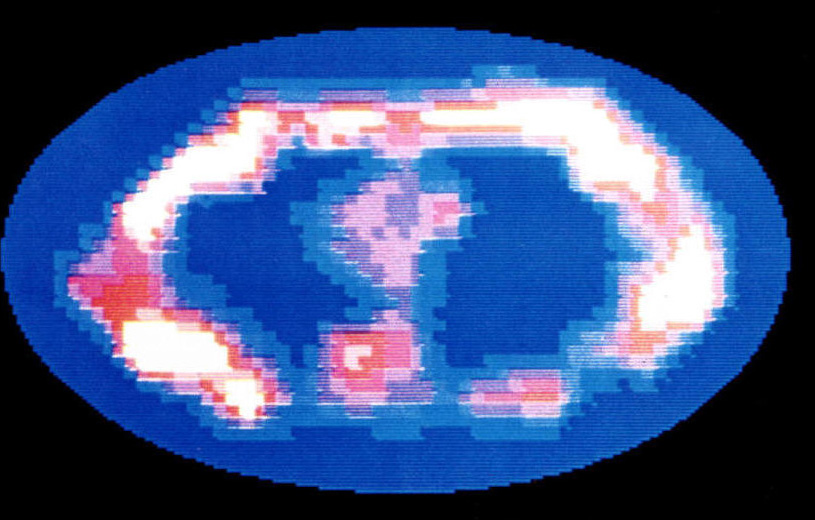
図11. Damadianが発表した世界初の体部MRI画像.第8胸椎レベルの胸部水平断.撮像時間4時間以上を要した[18].

図12.世界初の商用MRI装置, FONAR QED 80 [20].
この改良版QED 80 alphaは日本のMRI 1号機として導入
されたが,臨床的有用性を発揮できないままに終わった[17].
臨床用MRI装置の開発
これらの基礎技術の発展を背景に,1980年頃より各社で臨床用MRI装置の開発が始まった.臨床的有用性を最初に示したのは,イギリスのHammersmith病院のグループで,EMI社が開発した超電導0.15T頭部専用機を駆使して多発性硬化症の診断におけるMRIの有用性を報告した[21].しかしこれはむしろ例外的で,その他の疾患や,特に体部領域では,急速な進歩を遂げつつあるCTの前にMRIの臨床的有用性は懐疑的な臨床医が少なくなかった.初期の装置はほとんどが常電導磁石で,磁場強度も0.1Tあるいはそれ以下のものが多く,撮像法も手探り状態で,空間分解能,コントラストともにCTに伍することができなかった.
1979年に,Hoult,LauterburらがRFの感度分布の理論的研究から,人体の画像化は10MHz(0.2T)とするべきであるとし[22],Mansfieldもまた別の観点から10MHzを上限と考えていた[23].そのような中にあって,1981年,カリフォルニア大学サンフランシスコ校(UCSF)のLawrence CrooksらはOxford社の超電導マグネットを使用し,Diasonics社と共同で0.35T(15MHz)の装置を試作したが,予想外に良い結果が得られ,1981年末のRSNAで発表されたその画質は研究者に衝撃を与えた[→原著論文].これにより,静磁場の上限10MHzの呪縛が解かれ,開発の流れは高磁場装置へと向かった. 1980年にGE社でMRI開発にあたったPaul Bottomley,William EdelsteinはOxford社の最新の超電導マグネットを導入し,静磁場強度1.5Tを使用して高画質の頭部,体部画像の撮像に成功し,1983年に発表した[→原著論文].
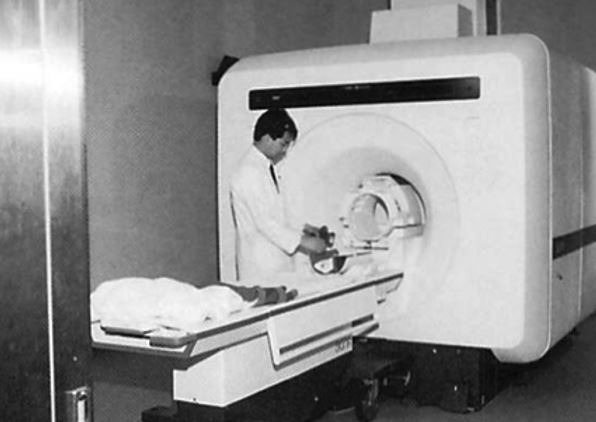
図13. GE社が初めて上市した1.5T MRI装置 Signa [慶應義塾大学病院]
1983年,1984年の学会(SMRM)では,0.35T,1.5Tのいずれが臨床に適しているか,UCSFのCrooksらとGEのBottomleyらの間で激しく議論が戦わされ,これはその後 field warと呼ばれることになった(→関連事項).SN比,緩和時間,コストなど様々な問題が議論されたが,結局学問的な議論よりも画質そのものが語る有用性から1.5T装置の勝利に終わり,以後2000年代に3T装置が登場するまで,超電導磁石の1.5T装置が臨床標準機となる一方で,永久磁石による0.2~0.3Tの低磁場装置は,オープン型MRIとして共存するようになった.
撮像法/画像再構成法もそれまでは,逆投影法(Philips,EMI),選択励起法(Diasonics),焦点磁場法(FONAR),Spin warp法(GE)など開発メーカーによって様々なものが使われていたが,1980年代初頭にはスピンワープ法[9]が一般化し,これらの技術をもとに,1984年以降,主要各社から臨床用MRI装置が商用機として次々と提供された(図13).
原著論文
《1982-0.35T装置》
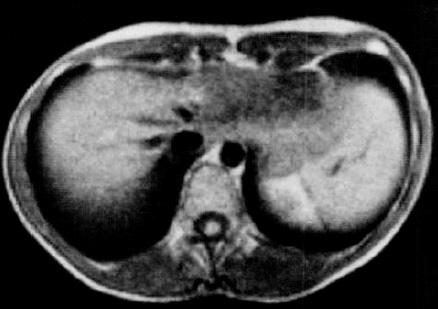
図14.0.35T 装置による腹部MRI.当時としては画期的な高画質で,研究者に衝撃を与えた.
【要旨】従来,RF波の人体による吸収などの問題のため,0.19~0.23T以上では全身撮像は難しいとされてきたが,3.5Kガウス(0.35T)超電導マグネットによるNMR撮像装置を使用した.ボア径85cm,長さ2m,体部コイルは径55cm,頭部コイルは径25cm.画像再構成は2次元フーリエ変換法,分解能は面内2×2.5cm,厚さ1cm,TR 0.5あるいは1.0秒,TE 28,56ミリ秒,加算回数4,撮像時間8.5分.このほか,T1計算画像,T2計算画像も作成した.
従来の低磁場装置の画像との比較における良し悪しを論ずるものではないが,頭部,体部いずれにおいても十分なSN比が得られ(図14),従来言われているRF波吸収の問題はなかった.
【解説】1979年にHoultら[22]が,RF波の浸透率の問題を論じて,人体の撮像は10MHz(0.23T)以下で行なうべきであるとして以来,MRI装置は専ら0.2T以下の低磁場で設計され,マグネットは常電導磁石が一般的であった.当時最の最も先進的な施設のひとつ,イギリスのHammersmith病院では超電導磁石を使用して比較的良い画像を作っていたが,磁場強度は0.15Tであった.
そのような中にあって,金科玉条であった10MHzの制限を超える15MHz, 0.35Tという.当時としては「高磁場」をあえて試みたのがこの論文である.撮影してみると,予想に反して従来の低磁場装置をはるかに凌ぐ高画質が得られた.この結果は1982年末のRSNAで報告されて世界の研究者に大きなインパクトを与え,それ以後の高磁場化への布石となった.
《1984-1.5T装置》
resonance at 1.5 teslas
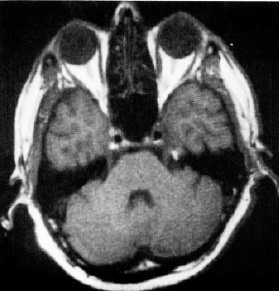
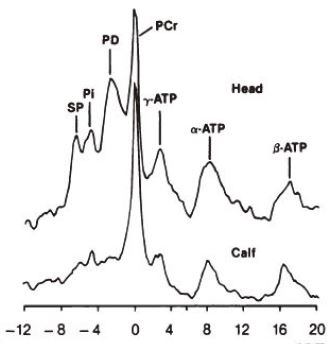
図15. 1.5T装置によるMRIとMRS.高磁場装置の有用性を実証し,以後MRIの標準的な静磁場強度となった.
【要旨】1.5Tの超電導マグネットによるMRイメージングおよびMRスペクトロスコピーを行なった.MRイメージングは,スピンエコー法,TR 0.2秒,TE 16ミリ秒,256×256マトリックス,面内分解能1mm×1mm,厚さ4mm,スキャン時間102秒.MRスペクトロスコピーは,側頭部および下肢筋のP-31, C-13,H-1スペクトルを計測した.
MRイメージングでは,従来言われていたRF浸透性の問題なく,5.1MHz(0.12T)装置に比して11倍のSN比が得られた(図13).初の頭部,体部の in vivoのスペクトロスコピーでは,リン酸化合物,アルキル基などの代謝物質を測定することができ(図15),疾患の診断への有用性を期待できる.
【解説】CrooksらUCSFの研究者が0.35Tによるイメージングに成功した翌年,GE社の研究開発グループが,一気に1.5Tという高磁場装置を導入してその画質を示すとともに,高磁場装置でなければ不可能なスペクトロスコピーの結果を示して,臨床検査装置としての高磁場MRIの有用性を立証した論文である.直後から,0.35Tとどちらが良いか,いわゆる "Field war" (→関連事項)が巻き起こったが,1985年にGE社が1.5T装置を発売し,以後現在に至るまで1.5Tが標準的な静磁場強度となるきっかけとなった.
関連事項
"Field war"
現在,臨床用MRIの静磁場強度は特殊な装置を除けば1.5~3Tが一般的であるが,1980年代後半から2000年代まで,標準的な高磁場MRIの静磁場強度は1.5Tであった.しかし,ここに落ち着くまでには激しい議論があった.
1970年代後半,NMRの画像化が実験室レベルで研究されていた時代,マグネットは常電導磁石で磁場強度も0.1T以下の装置が大部分で,その後人体の撮影が試みられるようになっても同様であった.その理由としては,常電導装置の場合,さらに磁場強度を高くするには大電力が必要となるという技術的な制約もあったが,1979年,イギリスのHoult,アメリカのLauterburの連名の論文[22]で,誘電損失の観点から人体の撮像は10MHz(0.2T)以下とすべきであるとされたことも一因であった.
1981年,カリフォルニア大学サンフランシスコ校(UCSF)では,Leon Kaufmanの指導の下,Lawrence CrooksがMRIの研究を開始した.Crooksはまず,15MHz(0.35T)の実験用MRIを使って動物実験を行ない,その後Diasonics社との共同研究で臨床用MRIを製作するにあたって,Oxford Instruments社の超電導磁石を導入した.Crooksは,Houltらが唱える10MHzの上限を承知の上で,あえてそれまで動物実験で使用していたものと同じ0.35Tを採用したところ予想外に良い結果が得られ,同年末のRSNAでの発表は多くの研究者に衝撃を与えた[→原著論文].これにより上限10MHzの呪縛が解かれ,開発の流れは高磁場装置へと向かうことになるが,これを一気に推し進めたのがGE社の開発陣であった.
当時のGE社はCTの販売が順調であったこともあり,MRIの有用性には懐疑的で研究開発は遅れていたが,1980年にイギリスの2大MRI研究拠点,Notthingham,Aberdeenからそれぞれ優秀な物理学者Paul Bottomley,William Edelsteinをスタッフに加えて開発に乗り出した.1982年,彼らはOxford社が開発したばかりの2T超電導マグネットを導入したが,2Tでの運用が不安定で,確実に使用できる磁場が1.5Tであったことから1.5T装置の開発を進め,1983年に高画質の頭部,体部画像の撮像に成功した[→原著論文].
しかし,1983年の第2回SMRMでBottomleyらがこれを発表すると,激しい批判が巻き起こった.最高磁場が0.35Tであった当時,いきなり1.5Tという高磁場が登場したことを考えると無理からぬ一面もあったが,その激しさはBottomleyらを当惑させるようなものであった.データの信憑性を疑問視する声や,非科学的とする批判もあった.特にUCSFのKaufman,Crooksらは攻撃的であったが,Edelsteinは壇上で,当時の流行歌の歌詞 " if you can't be with the one you love, love the one you're with" (愛する人と一緒になれないなら,一緒にいる人を愛しなさい)をもじって,"if you don’t have the field you love, love the field you have" と返したという[24].翌1984年の第3回SMRMでも,静磁場強度に関するセッションが設けられ,再び激しい応酬があった.Crooksらは,SN比,コントラストの観点から至適磁場強度を0.3~0.4Tとした[25].
この至適静磁場強度をめぐる一連の議論はしばしば "Field war" と言われるが,結局学会レベルで決着することはなかった.Bottomleyらは,いずれ時が経てば画質が証明するという考え方で静観し,高磁場を批判したHoultも1986年の論文では,現状では体部は0.5~1.0T,頭部は1.5Tが良いが,決して高磁場の使用を批判するものではない,と態度を軟化させている[26].GE社はさらに高磁場撮像に適したRFコイルの改良を進め,1983年に1.5Tの商用機Signaを発表した.その成功を見て各社も続々と1.5T機を投入するに至って標準機の静磁場強度1.5Tが確立し,Field warは高磁場装置の勝利に終わった.
MR 血管撮影 (MRA)
MR信号に対する血流の影響はNMRの時代から知られていたが,イメージングの観点から初めて分かりやすく整理して記述したのは1984年のAxelの総説[27]で,さらに1986年にはこれをTime-of-flight (TOF)という言葉を使って説明し,ファントム実験による流速計測を報告している[28].
初のMR血管撮影(MR angiography, MRA)の報告は,GE社の研究員 Dumoulinが1986年に著わした論文であるが[→原著論文],これはTOF効果を利用したものではなく,傾斜磁場(flow-encoding gradient)を利用してフローによる位相の変化を検出する位相コントラスト法MRA (Phase contrast MRA, PC法)であった.当初は2次元法であったが,1989年にはこれを3次元に拡張し,本格的なMRAが得られるようになった[29].PC MRA法は単に画像を表示するだけでなく流速を輝度に反映して定量できる利点がある一方で,2次元法でも2回,3次元法では6回の撮像を繰り返す必要があり,検査時間が長いという不利があった.
現在広く用いられている3次元グラディエント法を利用したTime-of-flight法(TOF法)によるMRAの初報は,Siemens社の研究員Laubが1988年に発表した論文[→原著論文]で,同時にMIP法による画像表示もあわせてここで紹介している.当初,PC法,TOF法の優劣については議論があったが[30,31],結局PC法に比べて短時間,簡便に撮像できるTOF法が臨床検査法として普及した.
TOF法MRAの臨床応用は最初期から特に脳動脈瘤の診断で評価され,1990年の初報以後[32],その有用性が早期に認められた.日本では健常者を対象とするMRAによる未破裂脳動脈瘤のスクリーニングが1990年から試みられ[33],「脳ドック」として独自の発展を遂げて今日に至っている.
原著論文
《1986-位相コントラスト法MRA》
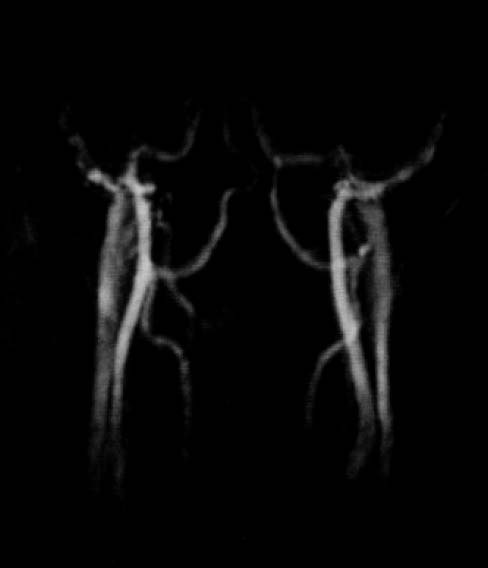
図16.頸部血管の位相コントラスト法MRA.
【要旨】移動するスピンと静止スピンでは勾配磁場を加えたときの位相変化が異なる事を利用して,移動するスピンを選択的に画像化する方法を考案した.位相を利用して,収縮期と拡張期の画像から血流を検出する方法は既に報告されているが,この場合は拍動流しか検出できない.本法は,極性の異なる対称性の勾配磁場,すなわちフローエンコード勾配磁場(flow encoding gradient)を加えて撮像し,これをサブトラクションすることにより,動脈,静脈ともに画像化することができる.フローエンコード勾配磁場は任意の1つあるいは複数の方向に印加できる.
特徴として,バックグラウンドの抑制が非常に良好であること,最大位相シフトが1ラジアン以下の場合,ピクセル輝度と輝度が概ね線形な関係にあるので流速を定量できることがある.ただし,位相シフトが1ラジアンを超えると,非線形性,周期性が発生することが問題である.1.5T装置で,健常ボランティアの頭部,頸部を撮影した.心電ゲートを使用し,256×128マトリックス,撮影時間4 ~16分で,動静脈が良好に描出できた(図16).
【解説】位相コントラスト(PC)法MRAの初報である.頭蓋内については,脳底部の頸動脈,太い硬膜静脈洞が描出されているが,頭蓋内の血管についてはあまり良くみえない.この後1989年の3次元法PCAの続報[29]では画質がかなり改善しているが,後続のTOF法にくらべると細い血管の描出能には劣る.またフローエンコード勾配を反転させてデータ収集を2回行なう必要があることから本質的に撮像時間は長い.TOF法MRAとの優劣が議論された時期がしばらくあったが,結局短時間で高分解能の画像が得られるTOF法が臨床検査として普及して現在に至る.PC法の最大の特長は,フローエンコード勾配の大きさを適切に設定することにより定量性が得られることで,理論的にはピクセル値から流速を読み取ることができる.また,勾配の方向を任意に設定して異方性のフローを計測できる.この特性を利用して,現在は主に研究用ツールとして利用されている.
《1988-Time-of-flight法MRA》
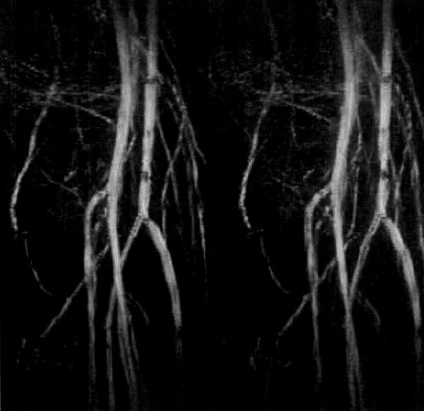
図17.膝窩動脈分岐部のTOF法MRA.最大値投影法(MIP)による表示.
【要旨】スピンエコー法のパルス系列では,血管は様々な輝度を示すが,これはボクセル内のスピンの位相が速度に応じて異なるためである.そこで,3つの傾斜磁場から成る速度補償傾斜磁場を追加して定速度スピンをリフェーズするGMR(gradient motion refocusing)法を考案した.これを用いると,定速度スピンはリフェーズされて静止スピンと同じ輝度になる(フロー増強画像).さらにフローを積極的にディフェーズして血管を低信号とする画像を作る(フロー抑制画像).前者から後者をサブトラクションすることにより,バックグラウンドを抑制した血管画像が得られる.この方法で動脈は収縮期にはリフェーズできず,拡張期にリフェーズするので,前者から静脈像,後者から動脈像が得られる.
GMR法をFLASHと組合わせると,TEが短いためにゲートが不要で,TRが短いため撮像時間も短縮して3D撮像が可能である(図17).この場合も,フローをリフェーズしたデータセットからディフェーズしたデータセットをサブトラクションする.得られた画像の表示法として,撮像ボリュームに平行光線を入射して,経路上の最大値を画像とする最大値投影法を提案した.これにより血管像のシネ表示も可能である.
【解説】MRAの初報は,この2年前のDumoulinによるPhase contrast法であったが,本稿はTOF法によるMR血管撮影(MRA)の初報である.ただここで論じているのは,単純にTOF効果(流入効果)を利用するものではなく,フロー補正傾斜磁場(GMR)を併用し,かつサブトラクションを行なう方法である.その意味で,TOF法MRAの初報であると同時に,現在は主にgradient moment nulling (GMN) あるいは flow compensation (FC)と呼ばれている速度項補正法の初報でもある.さらに,現在MRAの表示法として広く使われている最大値投影法(MIP)を初めて提案している点でも,その後のMRAのスタート地点となった論文である.
ガドリニウム造影剤
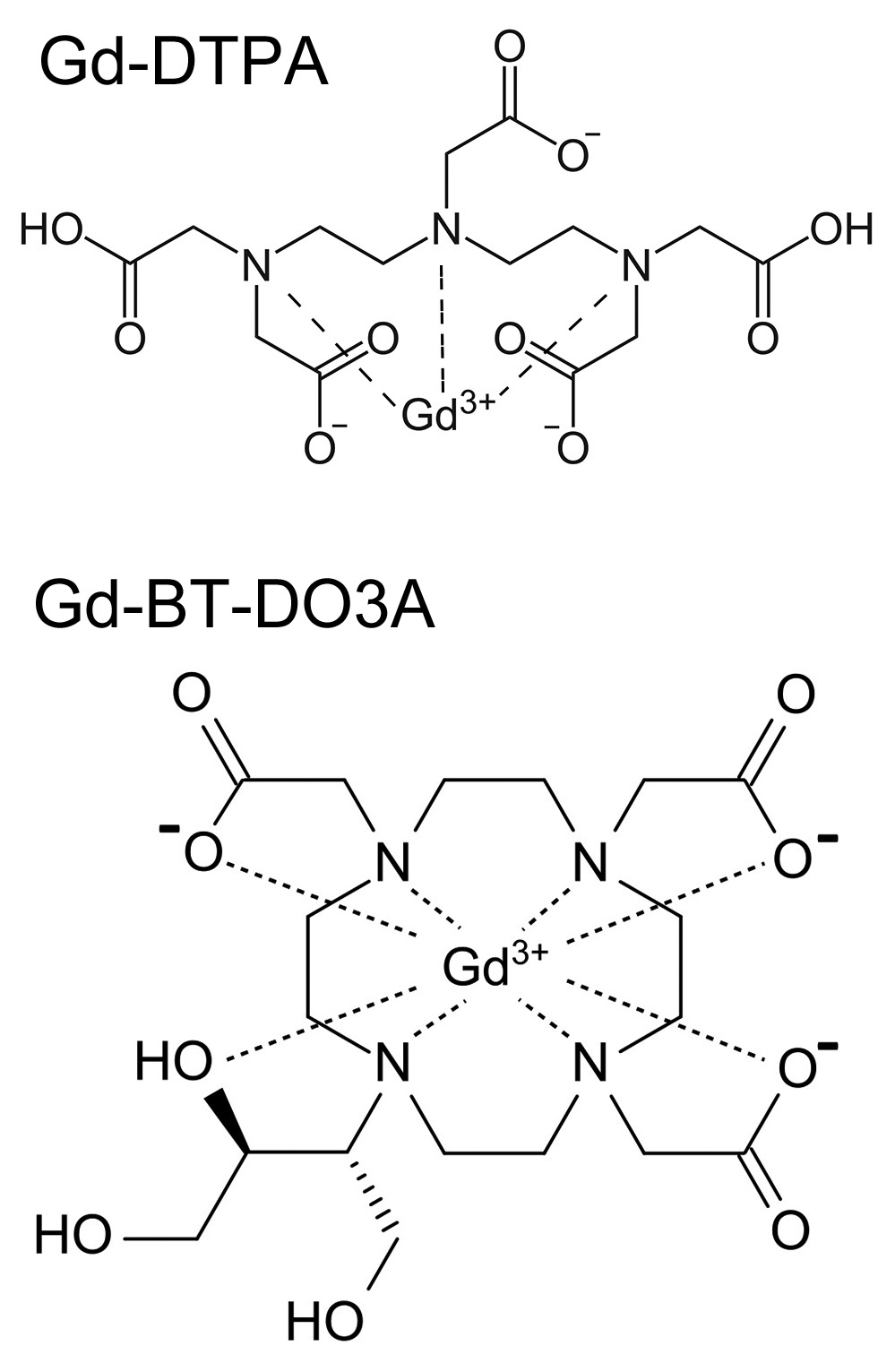
図18.上図:直鎖構造のGd-DTPA(マグネビスト).下図:環状構造のGd-BT-DO3A(ガドビスト).環状構造の製剤は安定性に優れ,ガドリニウムイオンの遊離が少ない.
常磁性体物質により物質の緩和時間が短縮することは,NMRスペクトロスコピーの時代から知られており,1978年頃から動物実験でマンガンなどのNMR画像における増強効果が散発的に報告されていた[34].しかし,臨床応用を念頭に,その安全性を初めて本格的に検討したのは,1984年,Schering社の研究者Hanns-Joachim Weinmannの論文で[→原著論文],Gd-DTPAの安全性を動物実験で示し,臨床応用の可能性を強く示唆するものであった.1983年11月からベルリン大学で臨床第1相試験が開始され,やや遅れて日本でも臨床試験が行われてその有用性が実証され[35],欧米では1987年,日本でも1988年6月からマグネビスト(Magnevist,一般名 gadopentetate dimeglumine)として臨床に供された.
その後のガドリニウム造影剤の開発は,2つの方向に進んだ.すなわち,非イオン性製剤,および環状構造製剤である.マグネビストは,水溶液中では3分子(Gd-DTPA2-と2個のメグルミン+)に電離していることから浸透圧は血液の約6倍となる.このためX線ヨード造影剤の開発の歴史にならい,1990年頃から非イオン性造影剤が開発された[36].しかし,ガドリニウム造影剤はもともと副作用発現率が非常に低く,投与量も少ないことから,低浸透圧のメリットはそれほど感じられず,神経毒性はかえって大きいという報告もあり[37],非イオン性製剤の優位性は必ずしも確立したものではなかった.
これと平行して,環状構造の製剤が開発された.環状構造は,従来の直鎖構造に比較してGdイオンの遊離が一段と少なく安全性が高いと考えられた[38](図18).しかしこれも臨床の場ではその優位性が明らかとなる場面は少なく,当時これらのガドリニウム製剤間には取り立てて優劣はないものと考えられた.
しかし,2006年に腎性全身性線維症(NSF, nephrogenic systemic fibrosis)*1とガドリニウム造影剤の関係が指摘されるにいたって[39,40],製剤間の差異があらためて検討され,特に直鎖構造製剤でNSFの発症が有意に高率であることが明らかとなった[41].さらに2014年,ガドリニウム造影検査を頻回に受けた患者において,微量ながらガドリニウムの脳内沈着が見られることが報告され[42]*2,これも直鎖構造の製剤に多い結果となった.NSF,脳内沈着ともに,化学構造の違いに基づく遊離ガドリニウムイオン濃度との関係が示唆されている.このような背景から,現在では特別な理由がない限り,環状構造製剤の使用が推奨されている*3.
*1 腎不全の患者に強皮症様の全身皮膚症状(浮腫,硬化)が出現し,進行性に四肢拘縮を来たして高度の運動障害を来たし,さらに骨格筋,心筋,腎など全身臓器に線維化を伴って時に致命的となる新たな病態が,2000年に初めて報告された.2003年,NSFと命名され,2006年に,MarckmannとGrobnerがそれぞれ独立にガドリニウム造影剤との因果関係を指摘した.
*2 ただし,脳内のガドリニウム沈着による臨床症状はこれまで報告されていない.またNSFについても,現在では検査前の腎機能測定に基づく厳格なガイドラインが設定されており,新たな発症はない.
*3 Gd-DTPA(マグネビスト)は2018年に国内製造販売が中止された.現在日本で市販されているMRI用経静脈性造影剤.
イオン性 直鎖構造:Gd-EOB-DTPA (プリモビスト)
イオン性 環状構造:Gd-DOTA (マグネスコープ,ガドテル酸メグルミン)
非イオン性 直鎖構造: Gd-DTPA-BMA (オムニスキャン)
非イオン性 環状構造: Gd-HP-DO3A (プロハンス,ガドテリドール静注シリンジHK),Gd-BT-DO3A (ガドビスト)
原著論文
《1984-Gd-DTPA》
【要旨】2種類のガドリニウムキレート(Gd-DTPA,Gd-EDTA)と,非キレートガドリニウムイオン(GdCl3)の緩和作用,生体の耐容性,薬物動態を比較した.キレート剤の緩和作用は,ガドリニウムイオンにくらべて弱く,Gd-DTPAはGd-EDTAよりも弱い.ラットの静注投与におけるLD50(mmol/kg)は,ガドリニウムイオン 0.5,Gd-EDTA 0.3,Gd-DTPA 10とGd-DTPAが最も大きく,脳槽内投与,クモ膜下腔内投与でもGd-DTPAが優れていた.Gd-DTPAの補体系への影響は,ほとんど認められなかった.Gd-DTPAは,主に腎から排泄され,血中半減期は20分で,7日後に投与量の90%が尿中に,7%が便中に排泄され,組織内残存は肝に0.08%,腎に0.1%であった.一方,GdCl3は7日後に排泄されるのはわずか2%で,大部分が肝脾に残存した.Gd-DTPAは,もっぱら細胞外に分布し,血液脳関門を通過しないと思われる.このような特性から,Gd-DTPAは,NMR造影剤として有望である.
【解説】ガドリニウム造影剤の臨床使用の端緒となった歴史的論文である.一般に稀土類元素は不対電子を多くもつことから常磁性が強く,緩和促進作用を持つことが知られており,特に7個の不対電子をもつガドリニウムは強力で,生化学におけるNMR研究でも使用されていた.ガドリニウムは単体ではイオンGd3+として存在し,強い毒性をもつが,大きな分子とキレート(錯体)を形成することにより生体への耐容性が大きく向上する.
ここでは,2種類のキレート剤,Gd-DTPA,Gd-EDTAを,非キレート化合物GdCl3(ガドリニウムイオンGd3+),およびヨード造影剤ジアトリゾ酸(アンギオグラフィン)を対照として比較検討し,緩和能ではやや劣るものの,耐容性,薬物動態の点からGd-DTPAが優れており,造影剤として有用であると結論している.
実際にはこの論文発表の時点で,既にドイツ国内でd-DTPA製剤の第1相臨床試験が進行しており,この論文に引き続いて動物,臨床例での有用性が報告されている[43,44].
出典
- 1. Bloch F, Hanson W, Packard M. Nuclear induction. Phys Rev 69:127,1946
- 2. Purcell EM, Torrey HC, Pound RV. Resonance absorption y nuclear magnetic moments in a solid. Phys Rev 69:37-8,1946
- 3. Odeblad E, Lindström G. Some preliminary observations on the proton magnetic resonance in biological samples. Acta Radiol (Stockholm) 43:469-076,1955;
- 4. Moon RB, Richartls JH. Determination of intracellular pH by 31P magnetic resonance. J Biol Chenr 48:7276-78,1973
- 5. Damadian R. Apparatus and method for detecting cancer in tissue. US Patent 3789832A (申請1972,認可1974)
- 6. First clinical trials of diagnostic NMR. Radiology/Nuclear Medicine Magazine, 8-12, June 12,1981
- 7. Mansfield P, Pykett IL, Morris PG. Human whole body line-scan imaging by NMR. Brit J Radiol 51:921-2,1978
- 8. Kumar A, Welti D, Ernst RR. NMR Fourier zeugmatography. J Magn Reson 18:69-83,1975
- 9. Lauterbur PC. Magnetic resonance zeugmatography. Pure Appl Chem 40:149-57,1974
- 10. Weisman I, Bennet LH. Recognition of cancer in vivo by nuclear magnetic resonance. Science 178:1288-90,1972
- 11. Lauterbur PC. One path out of many: How MRI actually began. In: Grant DM, et al. ed. Encylcopedia of nuclear magnetic resonance. John Wiley & Sons, 1996
- 12. Mansfield P, Grannlel PK. NMR 'diffraction' in solids? J Phys C: Solid State Phys 6:L422-6,1973
- 13. Grannel PK, Mansfield P. Microscopy in vivo by nuclear magnetic resonance. Phys Med Biol 20:477-82,1975
- 14. Mansfield P, Pykett IL, Morris PG. Human whole body line-scan imaging by NMR. Brit J Radiol 51:921-2,1978
- 15. Tanka K, Yamada Y, Shimizu T, et al. Fundamental investigations (in vitro) for a non-invasive method of tumor detection by nuclear magnetic resonance. Biotelemetry 1:337-50,1974
- 16. 古瀬和寛. NMR臨床応用の初動期と生体緩和時間研究の歩み. 日本磁気共鳴医学会雑誌 11:251-67,1991
- 17. 古瀬和寛. 磁気共鳴診断装置FONAR QED80-alpha導入の思い出. Med Imag Technol 17:284-9,1999
- 18. Sarpe G, Chaudry F, Hindo W. Magnetic resonance imaging of periventricular hyperintensity in a veterans administration hospital population. Arch Neurol. 44:725-8,1987
- 19. Damadian R, Goldsmith M, Minkoff L. FONAR image of the live human body. Physiol Chem Phys 9:97-100,1977
- 20. Ross RJ, Thompson JS, Kim K, et al. Site location and requirements for the installation of a nuclear magnetic resonance scanning unit. Magn Reson Imag 1:29-33,1982
- 21. Young IR, Hall AS. Pallis CA. et al. Nuclear magnetic resonance imaging of the brain in multiple sclerosis. Lancet 2:1063-66,1981
- 22. Hoult DI, Lauterbur PC. The sensitivity of the zeugmatographic experiment involving human samples. Hoult DI, Lauterbur PC. J Mag Reson 34:425-33,1979
- 23. Mansfield P, Morris PG. NMR Imaging in Biomedicine. (Academic Press New York, 1982)
- 24. Bottomley PA. On the origin of localized NMR: View from an accomplice. MRIS History UK 1-56,2019
- 25. Crooks LE, Arakawa M, Hoenninger J, et al. Magnetic resonance imaging: effects of magnetic field strength. Radiology. 151:127-33,1984
- 26. Hoult DI, Chen CH, Sank VJ. The field dependence of NMR imaging. II. Arguments concerning an optimal field strength. Magn Reson Med 3:730-46,1986
- 27. Axel L. Blood flow effects in magnetic resonance imaging. Am J Roentgenol 143:1157-66,1984
- 28. Axel L, Shimakawa A. A time-of-flight method of measuring flow velocity by magnetic resonance imaging. Mag Reson Imag 4:199-205,1986
- 29. Dumoulin CL, Souza SP, Walker MF, et al. Three-dimensional phase contrast angiography. Magn Reson Med 8;139:49,1989
- 30. Wagle WA, Dumoulin CL, Souza SP, et al. 3DFT MR angiography of carotid and basilar arteries. Am J Neuroradiol 10:911-9,1989
- 31. Huston III J, Rufenacht DA, Ehman RL, et al. Intracranial aneurysms and vascular malformations: Comparison of time-of-flight and phase-contrast MR angiography. Radiology 181:721-30,1991
- 32. Sevick RJ, Tsuruda JS, Schmalbrock P. Three-dimensional time-of-flight MR angiography in the evaluation of cerebral aneurysm. J Comput Assist Tomogr 14:874-51,1990
- 33. 馬淵順久. MRアンジオグラフィによる脳動脈瘤のスクリーニング. 日磁気共鳴医誌 12:1-7,1992
- 34. Lauterbur PC, Mendoça-Dias MH, Rudin AM. Augmentation of tissue water proton spin-lattice relaxation rates by in vivo addition of paramagnetic ions. In: Duton PL ed. Frontiers of Biological Energetics. Electron to Tissues. Volume 1.(Academic Press, New York, 1978)
- 35. 吉川宏起, 西川潤一,小坂登 他.MRI造影剤Gd-DTPA (dimeglumine gadopentetate)の臨床第1相試験. 画像診断6:959-69,1986
- 36. Greco A, McNamara MT, Lanthiez P, et al. Gadodiamide injection: nonionic gadolinium chelate for MR imaging of the brain and spine--phase II-III clinical trial. Radiology 176:451-6,1990
- 37. Takahashi M, Tsutsui H, Murayama C. Neurotoxicity of gadolinium contrast agents for magnetic resonance imaging in rats with osmotically disrupted blood-brain barrier. Magn Reson Imag 14:619-23,1996
- 38. Bousquet JC, Saini S, Stark DD, et al. Gd-DOTA: characterization of a new paramagnetic complex. Radiology166:693-8,1988
- 39. Marckmann P, Skov L, Rossen K, et al. Nephrogenic systemic fibrosis: suspected causative role of gadodiamide used for contrast-enhanced magnetic resonance imaging. J Am Soc Nephrol 17:2359–62,2006
- 40. Grobner T. Gadolinium: a specific trigger for the development of nephrogenic fibrosing dermopathy and nephrogenic systemic fibrosis? Nephrol Dial Transplant 21:1104–8,2006
- 41. Edward M, Quinn JA, Burden AD, et al. Effect of different classes of gadolinium-based contrast agents on control and nephrogenic systemic fibrosis–derived fibroblast proliferation. Radiology 256:735-43,2010
- 42. Kanda T, Ishii K, Kawaguchi H, et al. High signal intensity in the dentate nucleus and globus pallidus on unenhanced T1‒weighted MR images:relationship with increasing cumulative dose of a gadolinium‒based contrast material. Radiology 270:834‒841,2014
- 43. Brasch RC, Weinmann H-J, Wesbey GE. Contrast-enhanced NMR imaging: Animal studies using gadolinium-DTPA complex. Am J Roentgenol 142:625-30,1984
- 44. Carr DH, Brown J, Bydder GM, et al. Gadolinium-DTPA as a contrast agent in MRI: Initial clinical experience in 20 patients. Am J Roentgenol 143:215-24,1984
