- 画像下治療(IVR)2
- 血管塞栓術
- 原著論文
- 1968 初の経カテーテル的血管塞栓術
- 1974 塞栓物質ゼルフォーム
- 1975 塞栓物質シアノアクリレート
- 消化管出血の治療
- 原著論文
- 1963 血管造影による消化管出血部位の同定
- 1971 バソプレッシン動注による消化管出血の治療
- 1972 塞栓術による消化管出血の治療
- 血栓溶解療法
- 原著論文
- 1974 ストレプトキナーゼ動注による血栓溶解
- 1979 冠動脈血栓と心筋梗塞の因果関係を証明
- 関連事項
- 血栓溶解薬の歴史
画像下治療(IVR)2
血管塞栓術
血管IVRのもう1つの大きな適応は,腫瘍や血管病変の血管塞栓術である.腫瘍に対する外科的血管塞栓術を初めて試みたのは,1904年,アメリカの外科医Dawbarnで[1],頭頸部腫瘍の悪性腫瘍に対して,外頸動脈を外科的に切開してパラフィンと白色ワセリンの混合物を注入し,一部の症例で腫瘍の縮小を見たとしている.しかしその後同様の試みはほとんどなかった.1960年,アメリカの脳外科医Luessehopは,前頭葉の脳動静脈奇形に対して,総頸動脈を切開し,ここからメチルメタクリル酸の固形ボール(直径2.5~4.2mm)を15分置きに4個注入して,少なくとも一時的な塞栓に成功した[2].
IVRによる経カテーテル的塞栓術の初報は,1968年に行なわれた脊髄血管腫の鉛ペレットと筋肉片による塞栓術である[→原著論文].1972年には,経カテーテル的脳動静脈奇形塞栓が報告されているが,これもLuessehopの場合と同じように,固形のシリコーン樹脂をペレット状にした塞栓物質を使用している[3].
1970年代には,さまざまな塞栓物質が開発された.現在も広く使われているゼルフォーム(Gelfoam)は1974年にCareyらが臨床例を初めて記載している[→原著論文].液状塞栓物質のシアノアクリレートは,1972年にZanettiらが開頭術による使用を報告[4],1975年にDotterが初めて経カテーテル的に投与した[→原著論文].1974年にはソ連のSerbinenkoが離脱式バルーン(detachable balloon)による脳動脈塞栓を[6],1975年にGianturcoがスチールコイルにウール糸を結びつけて,腎細胞癌例の腎動脈塞栓を報告している[7].
.
原著論文
《1968-初の経カテーテル的血管塞栓術》
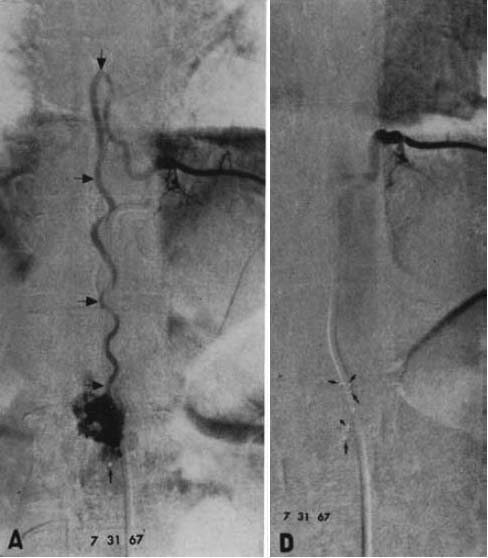
図1.(左)Adamkiewicz動脈を流入動脈とする血管奇形.(右)塞栓術後.病変は消失.
【要旨】 27歳男性,脊髄動静脈奇形.5年前に突然の背部痛,下肢筋力低下.椎弓切除後を行なったが血管病変については手術適応なしとされ,その後症状が再発,進行した.血管造影では,腰動脈からの上行枝とAdamkiewicz動脈からの下行枝,2本流入血管が認められた(図1).まず上行枝に鉛ペレットを注入したが塞栓できず,大腿四頭筋の筋肉片で塞栓した.3日後,下行枝にも同様にまず鉛ペレットを注入したが閉塞せず,筋肉片で完全で閉塞した.術後の血管造影で病変は消失した.患者の症状は徐々に回復し,術前は対麻痺であったが歩行可能となった.
【解説】 画像下治療(IVR)の重要分野のひとつである経カテーテル的血管塞栓術の初の報告例である.脊髄血管奇形の手術治療として全摘は難しく,かえって症状が悪化することが多かった.当時,流入動脈の結紮術が推奨され,少なくとも症状の悪化はないことから,外科的結紮にかえて経カテーテル的塞栓術を試みたものである.塞栓物質には,鉛ペレットと筋肉小片を使用しているが,これ以前にも,主に内頸動脈海綿静脈洞瘻に対して開頭下に金属片,筋肉片,ゼルフォームを塞栓物質として使用することは行なわれていた.1972年に同じく経カテーテル的な脊髄動静脈奇形の塞栓術7例を報告した Doppman,Di Chiroらは,ステンレス片と筋肉片を使用している[8].その後,様々な塞栓物質が開発され試みられるようになった.
《1974-塞栓物質ゼルフォーム》
【要旨】症例は34歳男性.中腸捻転によるイレウスで小腸切除,空腸-回腸末端吻合術後,上部消化管からの大量出血を繰返し,血管造影で左胃動脈から胃への出血が確認された.バソプレッシンの局所投与も奏効せず,全身状態不良のため再手術も難しいことから,経動脈的塞栓術が検討された.ゼルフォームを滅菌生理的食塩水に含浸して塞栓物質として使用し,直ちに止血に成功した.
【解説】 ゼラチンスポンジ(商品名:ゼルフォーム)は,ブタやウシの骨,皮膚,靱帯などを化学処理して得られたコラーゲンを主成分とする外科用止血材料で,1946年にその腹部手術野における止血効果が報告されて以来,広く用いられている[13].これを初めて血管塞栓物質として使用したのは,おそらく1967年の石森らの報告で,頸動脈海綿静脈洞瘻に対して開頭,直視下にゼルフォームを注入して塞栓に成功している[10].本論文は,ゼルフォームを経カテーテル的な塞栓物質として使用した初報である.1968年のNewtonらの自己凝血塊による脊髄血管奇形塞栓の報告を引用して,凝血塊はカテーテル内で破砕されやすいことを挙げており,このため異物による塞栓を試みたようである.なぜゼルフォームを選択したかについては記載がないが,当時既に一般的な外科止血材料で手近にあったことから自然な選択であったのであろう.
以後ゼルフォームはIVRによる塞栓物質のとして広く使われるようになり,特に日本では肝細胞癌など腫瘍の塞栓術に多く用いられ,現在にいたるまで最も基本的な塞栓物質のひとつである.しかしあくまで外科止血材料であり,これを細片として塞栓物質として使用することは禁忌と記載されており,オフラベルの使用である.この問題については,日本IVR学会がステートメントを発表している[11,12]
《1975-塞栓物質シアノアクリレート》
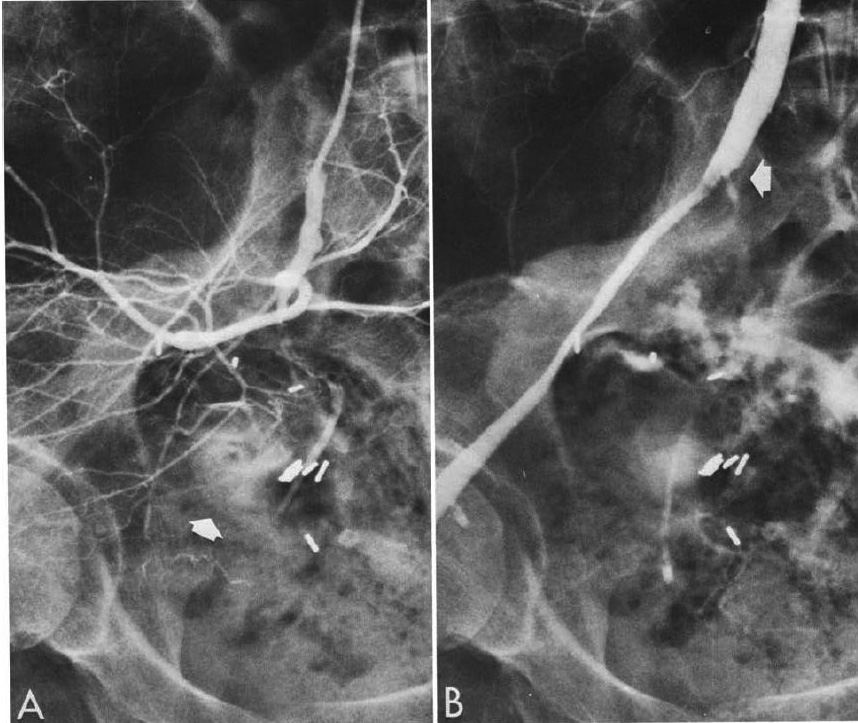
図2.骨盤内眼腫症からの大量出血.内腸骨動脈をICBで塞栓し,止血に成功した.
【要旨】瞬間接着剤イソブチル 2-シアノアクリレート (IBC)による血管閉塞術の有用性を,を動物実験および臨床例で確認した予備報告.動物実験はイヌ7頭,11血管に,IBC 0.3~0.5mlを2秒間で注入した.2頭が十二指腸梗塞,穿孔,虚血性膵炎で死亡した.その他の例ではあきらかな有害作用は認めなかった.剖検では血管腔内に血栓とICBの混合塞栓が認められ,血管壁の炎症性変化は軽度であった.
症例1,骨盤癌腫症による大量膣出血例で,IBC 0.9mlを内腸骨動脈内に注入し,ただちに止血できた(図2).症例2,慢性透析例で大量蛋白に対して,内科的腎摘術を目的として両側腎動脈にそれぞれICB 0.8mlを注入,ただちに閉塞が得られた.人体における長期作用についてはなお研究が必要である.動物実験例のように梗塞を来たすと危険な領域では致命的となりうるが,患者の救命も可能である.
【解説】 IBCはそれまでも血管吻合,創傷止血剤などとして医用利用されており,開頭下に脳動脈瘤や動静脈奇形に直接注入して塞栓物質とする方法も行われていたが,これを経カテーテル的血管内塞栓術として使用した初報である.動物実験では死亡例もあるが,量と部位を適切に選べば問題ないという立場で,緊急症例2例にこれを応用していずれも成功している.Dotter自身は,このICBに関する論文は1編しか著していないが[5],これを契機に各方面で応用が進み,現在では重要な永久塞栓物質のひとつとなっている.ここではIBC (IBCA) が使用されているが,現在は異性体 NBCA (n-butyl cyanoacrylate) が使われている.
消化管出血の治療
1963年,Nusbaum & Baumは,消化管出血の原因検索における血管造影の有用性を初めて報告し,経カテーテル的な消化管出血の治療の端緒を開いた[→原著論文].当時既に,門脈圧亢進に伴う食道静脈瘤の治療に,バソプレッシンの経静脈性全身投与が行なわれていたが,血圧低下など全身的な副作用を避けることができなかった.そこでまず試みられたのが,上腸間膜動脈への選択的バソプレッシン投与で,臨床的な有用性が証明された[→原著論文].ついで他の消化管出血に対しても,出血源となる動脈への選択的投与が試みられるようになった.
血管収縮薬にかわって塞栓物質による消化管出血治療は,1972年,Röschによる胃十二指腸潰瘍からの出血の自己凝血塊による塞栓成功例が初報[→原著論文]で,ほぼ同時期に骨盤骨折に伴う出血のやはり自己血による止血が報告されている[13].その後現在も使用されているゼルフォーム[→原著論文],NBCA[5]など様々な塞栓物質の報告が続いた.
原著論文
《1963-血管造影による消化管出血部位の同定》
【要旨・解説】 消化管出血部位の同定に,血管造影が有用であることを初めて明示し, その後の消化管出血に対する経カテーテル的塞栓術の端緒を開いたという点で重要な論文である.
25頭のイヌで,放射性同位元素(32P, 131I-HSA)の静注,経皮的大動脈造影,開腹動脈造影,経皮的選択的動脈造影の4つの方法を試み,簡単,確実,安全に消化管出血点を描出できる方法は,経皮的選択的動脈造影のみであると結論している.
経皮的選択的動脈造影は,Seldinger法で大腿動脈からカテーテルを挿入し,腹腔動脈,上腸間膜動脈,下腸間膜動脈を造影し,毎秒1枚の連続撮影を行なっている.この論文では具体的な出血の画像所見については言及されていないが,その後著者らは消化管出血の血管造影診断について継続的に症例を重ねてその有用性を報告している [14,15]
《1971-バソプレッシン動注による消化管出血の治療》
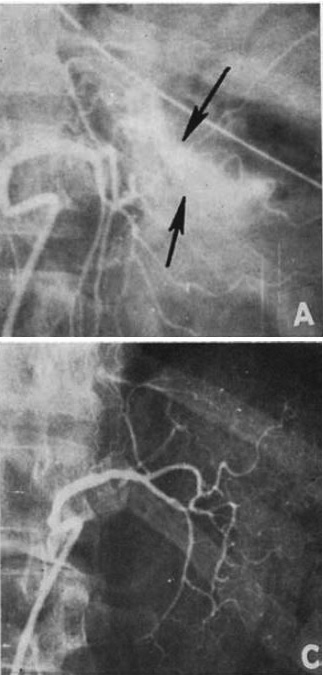
図3.Mallory-Weiss症侯群による出血の治療.(上)左胃動脈造影で,食道噴門移行部の造影剤の血管外漏出が認められる.(下)バソプレッシン投与後.血管が全体に収縮して止血に成功した.
【要旨・解説】IVRによる消化管出血の治療はこの論文を嚆矢とする.著者のBaumはペンシルベニア大学の外科医,Nusbaumは放射線科医で,消化管出血の血管造影診断,経カテーテル的止血法に関する研究の多くは,この2人が先鞭をつけたものである.1963年に,血管造影により消化管出血の診断が可能であることを初めて報告し[→原著論文],1967年には本文中にも引用されているように,動物に様々な血管収縮薬を投与して,作用機序の自律神経系に依存しないバソプレッシンが最も有効であることを示した[16].1968年[17],1969年[15]にそれぞれ少数の臨床例を予備的に報告しているが,本稿ははじめて,48例のまとまった症例数について,その手技と結果を報告している.
48例中28例は,血管造影上出血源不明であるが,門脈圧亢進症に伴う静脈瘤からの出血と考えられた例,8例は血管造影で出血源を同定できたMallory-Weiss症侯群,胃潰瘍などの症例で(図3),いずれもバソプレッシン投与開始数分で出血はとまり,その後数日間持続投与して再発はなかった.この他14例は,門脈体循環シャント術前で,術中の出血低減を目的としたもので,手術が容易になり手術時間が短縮したとしている.
手技は,門脈亢進例では上腸間膜動脈,その他の例は左胃動脈など出血源の血管で,診断造影を行なったカテーテルをそのまま使用してバソプレッシン 0.2単位/mL/分を基本として動注し,止血を確認後,数日間持続投与するとしており,現在行なわれている手技と基本的に同じである.
《1972-塞栓術による消化管出血の治療》
gastrointestinal bleeding
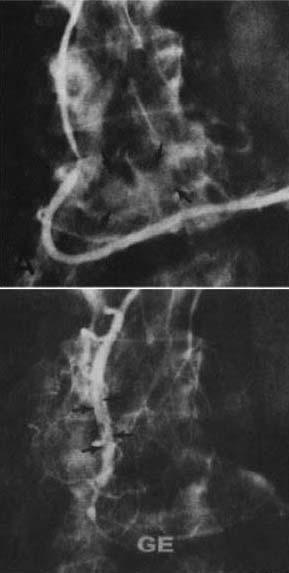
図4.胃潰瘍からの出血の治療.(上)胃大網動脈造影.造影剤の血管外漏出.(下)自己凝血塊による塞栓術後.
【要旨・解説】消化管出血の経カテーテル的治療法としての血管塞栓術の初報である.この前年に,バソプレッシン投与の有効性を報告したオレゴン大学のDotterのグループによるもので,塞栓物質としては自己凝血を使用している.
症例は重度肝機能障害のある43歳女性で,プレショック状態の胃十二指腸潰瘍出血を内科的にコントロールできず,全身状態不良のため外科適応もなく,血液凝固能不良のため血管収縮薬による治療も難しいと考えられたため,新たな方法を試みたものである.まずエピネフリンを動注し,その後自己凝血塊2ccを投与して止血に成功した(図4).13日後に全身状態の悪化で死亡したが,剖検にて治療部位に器質化血栓を確認できた.
ここでエピネフリンを使用しているのは,動物実験で自己凝血塊だけでは凝血が破砕してしまうが,その前後にエピネフリンを投与することによりこれを回避できるという事前の知見に基づくものである.1970年代には,その後様々な塞栓物質が開発され,急性期消化管出血のカテーテル治療は,IVR手技の重要な一分野となった.
血栓溶解療法
1933年,CRPの発見者としても知られるアメリカの内科医William Smith Tillettは,β溶連菌が産生する線維素溶解物質としてストレプトキナーゼ(streptokinase, SK)を発見した[18].1947年,イギリスの病理学者Robert MacFarlaneは,ヒトの尿に同様の作用を持つ物質を発見し[19],これは後にウロキナーゼ(urokinase, UK)と命名された[20].1959年,Johnsonらは,ボランティアにSKを全身投与し,実験的な血栓溶解効果を初めて報告した[21].1973年の臨床試験では,肺塞栓症におけるUK,SK全身投与のヘパリンに対する有用性が証明されたが[22],全身の出血性副作用への懸念から広く受入れられなかった.
1974年,Dotterは少量(全身投与量の約1/100)のSKを経カテーテル的に下肢動脈に局所投与して,好成績を報告した[→原著論文].1979年にはRentropが冠動脈にUKを投与し [→原著論文],1980年代になると末梢血管閉塞,ステント術後血栓に対するUKの局所投与の有用性がほぼ確立した[23][24].
しかし1980年代になると,遺伝子組換え技術により血漿中に生理的に存在する線溶物質t-PA(tissue plasminogen activator)を製剤化したアルテプラーゼ(alteplase)が登場した[→関連事項].t-PAはSK,UKと異なり,フィブリン特異性があり,フィブリン血栓存在下でしか活性を発揮しないため,比較的安全に経静脈的全身投与が可能となった.このため,急性期脳梗塞に対する経静脈的t-PA治療が行なわれるようになり[25],また急性心筋梗塞についてはprimary PCI,すなわちバルーン拡張術,ステント留置を最優先とし,何らかの事情によりこれが行えない場合に補助的に経静脈的t-PA投与を行なう方法が一般的となった[26].また急性肺塞栓症についても,全身投与が局所投与と同等の成績であることが明らかとなり,全身投与が行なわれるようになった[27].このため,IVRによる線溶薬の局所投与の適応は,四肢動静脈血栓症への主としてウロキナーゼの投与に限られているのが現状である.
原著論文
《1974-ストレプトキナーゼ動注による血栓溶解》
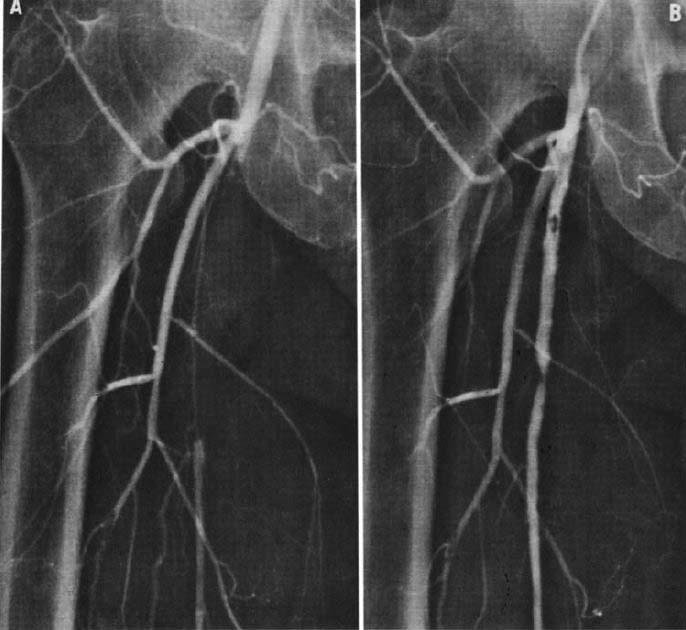
図5.(左)冠動脈造影後,穿刺部の血栓症.大腿動脈の起始部閉塞.(右)ストレプトキナーゼ投与24時間後.微小血栓を残して大腿動脈が大腿動脈の血流が回復している.さらに動注を継続し,45時間,30万単位の投与で血栓は完全に溶解した.
【要旨・解説】IVRによる血栓溶解療法の初報である.この時点でストレプトキナーゼ,ウロキナーゼの経静脈性全身投与の有効性は証明されていたが,これには10万単位/時を必要とし,全身性副作用ヘの懸念から普及していなかった.初めて,ストレプトキナーゼを経カテーテル的に,動脈内に直接投与してその有用性を示したのがこの論文である.
対象はカテーテルによる血管拡張術後7例,動脈硬化性閉塞7例,その他3例の計17例で,下肢15例,上肢2例である.カテーテルを血栓の直上に置くか,あるいは血栓内に刺入して,自動注入器でストレプトキナーゼを注入する.投与速度は5,000単位/時を標準とし,症例に応じて1~数日,最長2週間持続投与している(図5).結果は,術後の急性期血栓の成績は良好であるが,ある程度時間を経た血栓は不成功であった.
最後に肺,消化管,冠動脈,移植臓器の急性期病変などにも有用であろうと述べているが,実際この報告を機に線溶薬動注療法は急性期血栓症の治療法の重要な選択肢となり,現在の急性期心筋梗塞,脳梗塞のアルテプラーゼ治療に連なる一連の研究の糸口となった.
《1979-冠動脈血栓と心筋梗塞の因果関係を証明》
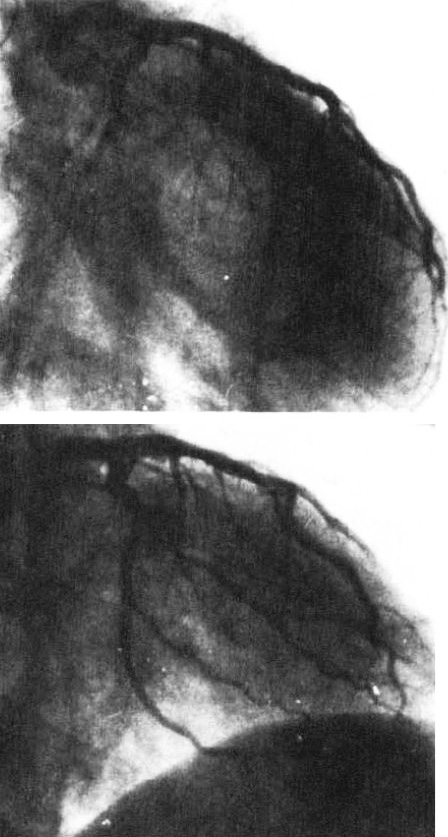
図6.急性心筋梗塞.(上)左冠動脈回旋枝の閉塞.(下)ストレプトキナーゼ冠動脈内投与後.回旋枝が良好に造影されている.
【要旨・解説】急性心筋梗塞で,冠動脈内に直接ストレプトキナーゼを動注し,治療に成功した初の報告である.それまでも,経静脈性の全身投与による治療の試みはあったが,その有効性が確認されていなかった.
対象は5例の急性心筋梗塞例で, いずれも緊急入院後,まずニトログリセリンを冠動脈に投与し,直後よりストレプトキナーゼをまずボーラスで1~2万単位,その後15~60分かけて1,000~2,000単位/時で持続動注し,全例で開存,臨床症状の軽快ないし消失が得られた(図6).治療経過中に冠動脈造影を頻繁に繰り返して,再疎通の状態を確認している.
その後の急性心筋梗塞の治療は,バルーンカテーテルによる再灌流治療(PCI)が急速に進歩し,現在ではPCIによる再灌流が優先され,線溶療法は補助的かつその場合も全身投与が行なわれ,冠動脈内投与が行なわれる機会はほとんどない.しかしこの論文の意義は,ストレプトキナーゼの冠動脈内投与ということよりも,心筋梗塞の原因が冠動脈閉塞にあるということを実証したことにある.
当時,急性心筋梗塞で冠動脈内に血栓が存在することは病理学的に知られていたが,血栓は梗塞の原因か結果かという議論があった.現在から見ると奇異に思えるが,原因ではないとする根拠として,流速の大きな冠動脈内に大きな血栓が形成されることへの疑問,また剖検例では必ずしも血栓が認められないことが挙げられていた.この論文は少数例とはいえ急性心筋梗塞における血栓の存在,その溶解過程を冠動脈造影により詳細に評価し,これが臨床所見,心電図所見の改善に平行することを直接的に示して,第1の疑問に答えた.さらに翌年,DeWoodら[28]も急性心筋梗塞322例について異なる時相の冠動脈造影を行ない,発症数時間で血栓が自然に縮小,消失しうることを示して第2の疑問を解決した.かくして,冠動脈内血栓と心筋梗塞の因果関係が確立され,その後の心筋梗塞治療の基盤を築くこととなった.
関連事項
血栓溶解薬の歴史
臨床的に使用される血栓溶解薬は,いわゆる線溶薬(fibrinolytic agents)で,血漿中のプラスミノーゲン(plasminogen)を限定分解してプラスミン(plasmin)を生成し,これが血栓の主たる成分である不溶性フィブリン(fibrin)を可溶性物質に分解することにより血栓を溶解する.プラスミノーゲンを活性化することから,一般にplasminogen activator (PA)と総称される.
ストレプトキナーゼ Streptokinase
1933年,溶連菌の産生物質として発見された初のPAである[18].1970年代に末梢血管,冠動脈への経カテーテル的局所投与による線溶治療の有用性を実証した事,ならびに1990年代前半のt-PAの臨床試験の多くで対照薬として使用された事において歴史的意義があるが,出血性副作用が多いためその後ほとんど使われなくなった.1990年代にはあらためてヨーロッパ,オーストラリアで急性期脳梗塞に経静脈性全身投与の大規模比較試験も行なわれたが,治療群の成績不良のため中断されている.欧米では現在も心筋梗塞,肺塞栓に対する全身投与の適応が認められた製剤があるが,実際にはほとんど使用されていない.日本では現在,血栓溶解薬としての製剤はない.
ウロキナーゼ Urokinase
1947年にヒト尿から発見されたUrokinaseは[19],初期は尿を集めて精製されたが,まもなく培養細胞から得られるようになった.その後,全身投与,局所投与の有用性が認められ,脳梗塞,心筋梗塞,末梢動脈血栓症の治療に広く使われた.しかし,UrokinaseはStreptokinaseと同じく非特異的なPAで,特に経静脈的に投与すると全身の血中プラスミノーゲンに作用するため,出血リスクの増大は不可避である.現在も,脳血管,末梢血管に対する経静脈性投与,冠動脈への動注の適応が認められているが,t-PAの登場により適応は大きく縮小している.IVRによる末梢血管への局所投与使用は,オフラベルである.
アルテプラーゼ Alteplase
Urokinaseと異なり,本来生体に存在する組織型PA (tissue PA, t-PA)は,フィブリン特異性を有し,血栓の本態であるフィブリンの存在下でのみプラスミノーゲンを活性化するため,経静脈的に投与しても予期せぬ出血のリスクを低減できる.生体内には微量しか存在しないため,精製が難しかったが,1980年代に遺伝子組換え型 t-PA (recombinant t-PA, rt-PA), Alteplaseが登場した.1993年には心筋梗塞に対するStreptokinaseに対する優越性が実証された(GUSTO)[29].やや遅れて脳梗塞への臨床試験が開始され,1995年に発症3時間以内の脳梗塞に対する有用性が証明され(NINDS)[30] ,2008年には適応時間が4.5時間まで延長された(ECASS3)[31].現在のところ,急性期脳梗塞,急性心筋梗塞への全身投与の適応が認められているが,急性心筋梗塞についてはバルーン血管形成,ステント留置によるPCIが優先される.
デューテプラーゼ Duteplase
日本で1980年代から,急性期脳梗塞の治療薬として開発され,世界に先駆けてその有効性が報告されたが[32],Alteplase を製造販売する米国の製薬会社から特許権侵害で訴えられて敗訴し,製品化の道が閉ざされた.このため,日本でもAlteplase採用のために臨床試験を実施する必要に迫られたが,欧米で既に有効性が確立している薬剤をプラセボと比較することは倫理的に問題があり,NINDSに準ずる実薬のみの臨床試験が行なわれ(J-ACT)[33],欧米に遅れること10年(関係者の間では「空白の10年」と呼ばれている),2005年にようやく急性期脳梗塞のt-PA治療が可能となった.
デスモテプラーゼ Desmoteplase
吸血コウモリの唾液が線溶効果を持つことは既に1932年に発見されていたが,1966年にPAが含まれることが明らかとなった[34].ヒトt-PAと構造的に類似しており,その後遺伝子組換え技術により合成され,Desmoteplaseとして製剤化された.Alteplaseよりも半減期が長く,フィブリン特異性も高いことから期待されたが,急性期脳梗塞を対象として2009年から米国で開始された臨床試験(DIAS3)で有効性が証明されず,臨床応用には至らなかった.
モンテプラーゼ Monteplase
Native t-PAから遺伝子組換え技術で合成された第2世代t-PA.Alteplaseはよりも半減期が長いため,投与量を少量に抑えることができる利点があり,その他の副作用も少ないとされる[35].Alteplaseは55分でピーク濃度に達し,その後の半減期6.3分で分解されるが,Monteplaseは,ピーク時間5分,半減期23.6分と即効性,持続性がある.急性心筋梗塞,肺動脈血栓症に対する経静脈性投与の適応が認められている.
現在日本で承認されているt-PA製剤は,アルテプラーゼ(商品名 アクチバシン,グルトバ.適応:急性期脳梗塞,急性心筋梗塞),モンテプラーゼ(商品名 クリアクター.適応:急性心筋梗塞,急性肺塞栓症)で,いずれも経静脈的全身投与が行なわれ,経カテーテル的局所投与は適応外である.米国では,その他のrt-PAとしてTenecteplase*, Reteplaseが急性心筋梗塞に使用されており,いずれもAlteplaseに対する優越性が証明されている.
*2021年,本邦でTenecteplaseの急性期脳梗塞への適応について臨床試験が開始された.
出典
- 1. Dawbarn RHM. The starvation operation for malignancy in the external carotid area. JAMA 17:792-5,1904
- 2. Luessenhop AJ. Artificial embolization of cerebral arteries. JAMA 172:119-21,1960
- 3. Kricheff II. Transfemoral catheter embolization of cerebral and posterior fossa arteriovenous malformations. Radiology 103:107-11,1972
- 4. Zanetti PH, Sherman FE. Experimental evaluation of a tissue adhesive as an agent for the treatment of aneurysms and arteriovenous anomalies. J Neurosurg 36:72-9,1972
- 5. Rösch J, Goldman ML, Dotter CT. Experimental catheter obstruction of the gastric coronary vein. Possible technique for percutaneous intravascular tamponade of the gastroesophageal varices. Invest Radiol 10:206-11,1975
- 6. Serbinenko, FA. Balloon catheterization and occlusion of major cerebral vessels. J Neurosurg 41:125-45,1974
- 7. Gianturco C, Anderson JH, Wallace S. Mechanical devices for arterial occlusion. Am J Roentgenol 124:428-35,1975
- 8. Doppman JL, Di Chiro G, Ommaya AK. Percutaneous embolization of spinal cord arteriovenous malformations. J Neurosurg 34,48-55,1971
- 9. Jenkins HP, Janda R. Studies on the use of gelatin sponge or foam as a hemostatic agent in experimental liver resections and injuries to large veins. Ann Surg 124:952-61,1946
- 10. Ishimori S, Hattori M, Shizawa H, et al. Treatment of carotid-cavernous fistula by gelfoam embolization. J Neurosurg 27:315-9,1967
- 11. 日本インターベンショナルラジオロジー学会. 日本では血管内投与禁忌とされている塞栓物質についてのステートメント. 2008
- 12. 日本インターベンショナルラジオロジー学会. 血管塞栓術に用いるゼラチンスポンジのガイドライン2013(第2版). 2015
- 13. Margolies MN, Ring EJ, Waltman AC, et al. Arteriography in the management of hemorrhage from pelvic fractures. New Eng J Med 287:317-21,1972
- 14. Baum S, Nusbaum M, Clearfield HR, et al. Angiography in the diagnosis of gastrointestinal bleeding. Arch Int Med 119:16-24,1967
- 15. NusbaumM, Baum S, Blakemore WS. Clinical experience with the diagnosis and management of gastrointestinal hemorrhage by selective mesenteric catheterization. Ann Surg 170:506-14,1969
- 16. Nusbaum M, Baum S, Sakyalak P, et al. Pharmacologic control of portal hypertension. Surgery 62:299-310,1967
- 17. Nusbaum M, Baum S, Kuroda K. Control of hypertension by selective mesenteric arterial drug infusion. Arch Surg 97:1005-13,1968
- 18. Tillett WS, Garner RL. The fibrinolytic activity of hemolytic streptococci. J Exp Med 58:485-8,1933
- 19. MacFarlane RG, Pilling J. Fibrinolytic activity of normal urine. Nature 159:779-85,1947
- 20. Sobel GW, Mohler R, Jones NW, et al. Urokinase: an activator of plasma profibrinolysin extracted from urine. Am J Phyisiol 171:768-9,1952
- 21. Johnson AJ, McCarty WR. The lysis of artificially induced intravascular clots in man by intravenous infusions of streptokinase. J Cllin Invest 38:1627-43,1959
- 22. Urokinase-Streptokinase embolism trial. Phase 2 results. JAMA 229:1606-13,1974
- 23. Totty WG, et al. Low-dose intravascular fibrinolytic therapy. Radiology 143:59:69.1982
- 24. McNamara TO, Fisher JR. Thrombolysis of peripheral arterial and graft occlusions: improved results using high-dose urokinase. Am J Roentgenol 144:769-75,1985
- 25. 脳卒中治療ガイドライン2015(追補2019)
- 26. 急性冠症侯群ガイドライン(2018年改訂版)
- 27. 肺血栓塞栓症および深部静脈血栓症の診断,治療,予防に関するガイドライン(2017年改訂版)
- 28. DeWood MA, Notske SR, Mouser LT, et al. Prevalence of total coronary occlusion during the early hours of transmural myocardial infarction. New Eng J Med 303:897-902,1980
- 29. GUSTO investigators. An international randomized trial comparing four thrombolytic strategies for acute myocardial infarction. N Eng J Med 329:673-82,1993
- 30. The National Institute of Neurological Disorders and Stroke rt-PA Stroke Study Group. Tissue plasminogen activator for acute ischemic stroke. N Engl J Med 333:1581-7,1995
- 31. Hacke W, et al. ECASS Investigators. Thrombolysis with alteplase 3 to 4.5 hours after acute ischemic stroke. N Eng J Med 35:1317-29,2008
- 32. Mori E, Yoneda Y, Tabuchi M, et al. Intravenous recombinant tissue plasminogen activator in acute carotid territory stroke. Neurology 42:976-82,1992
- 33. Yamaguchi T, Minematsu K, Nakagawa J. Alteplase at 0.6mg/kg for acute ischemic stroke within 3 hours of onset. Stroke 37:1810-15,2006
- 34. Medcalf RL. Desmoteplase: discovery, insights and opportunities for ischaemic stroke. Brit J Pharmacol 165:75-89,2012
- 35. Inoue T, Yaguchi I, Takayanagi K, et al. A new thrombolytic agent, monteplase, is independent of the plasminogen activator inhibitor in patients with acute myocardial infarction: initial results of the COmbining Monteplase with Angioplasty (COMA) trial. Am Heart J 144:E5,2005
